题目内容
4.现有a~g 7种短周期元素,它们在周期表中的位置如下,请据此回答下列问题: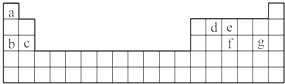
①元素的原子间反应最容易形成离子键的是B.
A.c和f B.b和g C.d和gD.b和e
②d与g元素形成的分子中所有原子是(填“是”或“不是”)都满足最外层为8电子结构.
分析 由周期表中位置知:a为H,b为Na,c为Mg,d为C,e为N,f为P,g为Cl;
①活泼的金属与活泼的非金属之间是容易形成离子键,非金属元素间一般形成共价键;
②d与g元素形成的分子为四氯化碳.
解答 解:由周期表中位置知:a为H,b为Na,c为Mg,d为C,e为N,f为P,g为Cl;
①A.c和f为Mg、P,可形成离子化合物;
B.b和g为Na、Cl,易形成离子化合物NaCl;
C.d和g为C、Cl,易形成共价化合物;
D.b和e为Na、N,可形成离子化合物;
活泼金属与活泼非金属最易形成离子化合物,只有B符合,
故答案为:B;
②d与g元素形成的分子为CCl4,其电子式为
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、元素化合物知识等为解答的关键,侧重分析与应用能力的考查,注意化合物中的化学键及原子最外层电子分析,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
9.下列物质是纯净物的是( )
| A. | 盐酸 | B. | 冰醋酸 | C. | 漂白粉 | D. | 淀粉 |
9.关于周期表和周期律,下列说法中正确的是( )
| A. | 在周期表中,元素的族序数都等于其原子的最外层电子数 | |
| B. | ⅦA族元素的单质,随分子量的增大,熔、沸点升高;ⅠA族单质,随分子量的增大,熔、沸点下降 | |
| C. | 周期表中非金属性最强的元素,其最高价氧化物的水化物酸性也最强 | |
| D. | 同主族元素随原子核电荷数的递增,原子半径依次增大 |
14.设NA为阿伏伽德常数的数值,下列说法正确的是( )
| A. | 18 g H2O含有10NA个质子 | |
| B. | 25℃时,PH=13的NaOH溶液中含有的OH- 数目为0.1NA | |
| C. | 标准状况下,22.4 L氨水含有NA个NH3分子 | |
| D. | 56 g铁片投入足量浓H2SO4中生成NA个SO2分子 |