题目内容
2005年1月,美国科学家在《Science》上发表论文,宣布发现Al的超原子结构,如Al13、Al14,并用质谱仪检测到稳定的Al13I--等,Al13、Al14的一些性质像其它的主族元素的化学性质,得到或失去电子生成40个价电子的最稳定状态.下列说法中不正确的是( )
| A、Al13与卤族单质的性质相似 |
| B、Al14与第IIA族元素的性质相似 |
| C、Al13在一定条件下与HI反应的化学方程式:Al13+HI=HAl13I. |
| D、Al14中的Al原子间以离子键相结合 |
考点:铝的化学性质
专题:元素及其化合物
分析:A.得到或失去电子生成40个价电子的最稳定状态,Al13有39个价电子极易得一个电子成稳定的Al13-,与卤素性质相似;
B.得到或失去电子生成40个价电子的最稳定状态;
C.用质谱仪检测到稳定的Al13I-等;
D.Al14为分子晶体.
B.得到或失去电子生成40个价电子的最稳定状态;
C.用质谱仪检测到稳定的Al13I-等;
D.Al14为分子晶体.
解答:
解:A.得到或失去电子生成40个价电子的最稳定状态,Al13有39个价电子极易得一个电子成稳定的Al13-,与第ⅤⅡA族卤素原子性质相似,故A正确;
B.得到或失去电子生成40个价电子的最稳定状态,Al14有42个价电子极易失二个电子成稳定的Al142+,与第IIA族性质相似,故B正确;
C.用质谱仪检测到稳定的Al13I-等,所以能与HI反应生成HAl13I,方程式为Al13+HI=HAl13I,故C正确;
D.Al14为分子晶体,Al14超原子中Al原子间通过共价键结合,故D错误;
故选D.
B.得到或失去电子生成40个价电子的最稳定状态,Al14有42个价电子极易失二个电子成稳定的Al142+,与第IIA族性质相似,故B正确;
C.用质谱仪检测到稳定的Al13I-等,所以能与HI反应生成HAl13I,方程式为Al13+HI=HAl13I,故C正确;
D.Al14为分子晶体,Al14超原子中Al原子间通过共价键结合,故D错误;
故选D.
点评:本题是一定信息题,是对学生信息的提取、阅读能力及综合能力考查,题目难度中等,侧重分析能力及知识迁移应用能力考查,关键是对信息的理解.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
 如图所示是典型氯碱工业的关键设备--离子交换膜电解槽,该电解槽的特点是用离子交换膜将槽分隔为左右两室,它能够阻止一些物质通过,也能允许一些物质通过.下列有关说法正确的是( )
如图所示是典型氯碱工业的关键设备--离子交换膜电解槽,该电解槽的特点是用离子交换膜将槽分隔为左右两室,它能够阻止一些物质通过,也能允许一些物质通过.下列有关说法正确的是( )| A、离子交换膜的特点是允许气体分子通过,而不允许阴离子通过 |
| B、图中X是指氧气 |
| C、电解槽右室的电极反应式为2H++2e-═H2↑ |
| D、电解槽左室也称为阴极室 |
为了降低宇航员所在的轨道舱和返回舱内二氧化碳的浓度,同时保证舱内宇航员吸收新鲜的氧气,请问舱内放入下列哪种物质能满足上述要求( )
| A、H2O |
| B、Na2O2 |
| C、KClO3 |
| D、KMnO4 |
下列物质在水中的电离方程式中正确的是( )
A、NaHSO4═Na++HSO
| ||
| B、AlCl3═Al+3+3Cl- | ||
| C、KClO3═K++Cl-+3O2- | ||
D、Al2(SO4)3═2Al3++3SO
|
8克铜与一定量浓硝酸完全反应得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与a L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.则a的值为( )
| A、2.8 L |
| B、1.4 L |
| C、3 L |
| D、4.2 L |
下列叙述或表示正确的是( )
| A、常温下pH均为3的醋酸和硫酸的水溶液,分别加水稀释100倍后,两种溶液的pH仍相同 |
| B、氢氧化钙溶液中加入过量的碳酸氢钙溶液的离子方程式:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| C、Ksp反映了难熔电解质在水中的溶解能力,它的大小与浓度无关,与温度无关 |
| D、c(H+)=1×10-2 mol?L的溶液:Fe2+、Ba2+、N03-、Cl-能大量共存 |
一定质量的Fe2O3、ZnO、CuO的固体混合粉末,在加热条件下用足量CO还原,得到金属混合物4.82g,将生成的CO2气体用足量的澄清石灰水吸收后,产生l0g白色沉淀.若用2mol?L-1的盐酸溶解该混合物,至少需要盐酸的体积为( )
| A、50 mL |
| B、100 mL |
| C、200 mL |
| D、缺少数据,无法计算 |
下列说法正确的是( )
| A、CO2与CaO化合是放热反应,则CaCO3分解是吸热反应 |
| B、需要加热方能发生一定是吸热反应 |
| C、若反应X+Y═M是放热反应,该反应一定不用加热 |
D、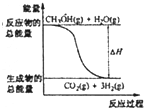 CH3OH(g)+H2O(g)═CO2(g)+3H2(g)反应能量变化如图所示,CH3OH转变H2的过程要吸收能量 |
 实验室需要配制0.1mol/L CuSO4 溶液980mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制0.1mol/L CuSO4 溶液980mL.按下列操作步骤填上适当的文字,以使整个操作完整.