题目内容
8克铜与一定量浓硝酸完全反应得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与a L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.则a的值为( )
| A、2.8 L |
| B、1.4 L |
| C、3 L |
| D、4.2 L |
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:混合后通入水中,所有气体完全被水吸收完全生成HNO3,则整个过程中HNO3 反应前后没有变化,即Cu失去的电子都被O2得到,根据得失电子守恒:n(Cu)×2=n(O2)×4,以此计算.
解答:
解:混合后通入水中,所有气体完全被水吸收完全生成HNO3,则整个过程中HNO3 反应前后没有变化,即Cu失去的电子都被O2得到,
根据得失电子守恒可知,n(Cu)×2=n(O2)×4,
则
×2=
×4,
解得a=1.4L,
故选B.
根据得失电子守恒可知,n(Cu)×2=n(O2)×4,
则
| 8g |
| 64g/mol |
| aL |
| 22.4L/mol |
解得a=1.4L,
故选B.
点评:本题考查氧化还原反应的计算,为高频考点,把握电子守恒的计算为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
下列关于常见有机化合物的说法中,正确的是( )
| A、乙烯和聚乙烯都能与溴的四氯化碳溶液发生加成反应 |
| B、甲烷和苯都能发生氧化反应和取代反应 |
| C、乙醇和乙酸分子中都含羟基,都能与NaOH发生反应 |
| D、糖类、油脂和蛋白质都是人体必需的营养物质,它们的组成元素相同 |
设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A、在标准状况下,以任意比例混合的CH4与CO2 的混合物22.4L,所含有的分子数为NA |
| B、在标准状况下,NA个H2O 分子所占体积为22.4L |
| C、常温常压下,活泼金属从盐酸中置换出1molH2,发生转移的电子数为2NA |
| D、常温常压下,28g氮气含有的核外电子数为10 NA |
下列关于有机物的说法中错误的是( )
| A、甲苯、葡萄糖和乙醇均能使酸性高锰酸钾溶液褪色 |
| B、在鸡蛋白溶液中加入浓Na2SO4溶液,蛋白质发生变性 |
| C、乙酸乙酯、油脂与NaOH溶液反应均有醇生成 |
| D、分子式为C7H8O属于芳香族化合物的同分异构体有5种 |
某有机物结构简式如图所示(未表示出其空间构型).下列它的性质描述不正确的是( )
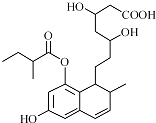

| A、能与FeCl3 溶液发生显色反应 |
| B、能使酸性KMnO4溶液褪色 |
| C、能发生加成、取代、消去反应 |
| D、1mol该物质最多可与3mol NaOH反应 |
2005年1月,美国科学家在《Science》上发表论文,宣布发现Al的超原子结构,如Al13、Al14,并用质谱仪检测到稳定的Al13I--等,Al13、Al14的一些性质像其它的主族元素的化学性质,得到或失去电子生成40个价电子的最稳定状态.下列说法中不正确的是( )
| A、Al13与卤族单质的性质相似 |
| B、Al14与第IIA族元素的性质相似 |
| C、Al13在一定条件下与HI反应的化学方程式:Al13+HI=HAl13I. |
| D、Al14中的Al原子间以离子键相结合 |
几种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是( )
| 元素代号 | L | X | R | T |
| 原子半径/nm | 0.191 | 0.102 | 0.154 | 0.074 |
| 主要化合价 | +1 | +6、-2 | +1 | -2 |
| A、L单质的熔点比R单质的高 |
| B、T对应的氢化物的沸点比X对应的氢化物高 |
| C、R单质在氧气中燃烧生成R2O2 |
| D、L、X形成的简单离子核外电子数相等 |