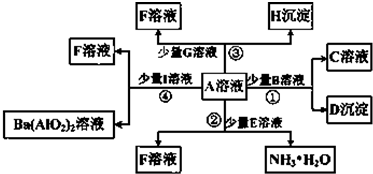
题目内容
 实验室需要配制0.1mol/L CuSO4 溶液980mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制0.1mol/L CuSO4 溶液980mL.按下列操作步骤填上适当的文字,以使整个操作完整.(1)选择仪器.完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、量筒、
(2)计算.配制该溶液需取胆矾晶体
(3)称量.
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是
(5)转移、洗涤.在转移时应使用
(6)定容,待容量瓶中溶液的凹液面正好与刻度线相切,盖好瓶塞后的下一步操作是
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,请你填写标签
(8)定容时,若加入的水超过刻度线,必须采取的措施是
(9)下列操作对CuSO4 的物质的量浓度有什么影响(填“偏高”、“偏低”或“无影响”)?
①转移溶液后,未洗涤烧杯:
②容量瓶用水洗净后未烘干:
③定容时俯视容量瓶的刻度线:
考点:溶液的配制
专题:实验题
分析:(1)配制980mL的硫酸铜溶液,需要选用1000mL的容量瓶,根据配制1000mL 0.1mol/L CuSO4溶液步骤选用仪器;
(2)根据m=cVM计算配制1000mL 0.1mol/L CuSO4溶液需要胆矾的质量;
(4)通过玻璃棒的搅拌可以加速硫酸铜的溶解;
(5)转移溶液时,通过玻璃棒引流,可以避免溶解的硫酸铜流到容量瓶以外;还需要洗涤烧杯和玻璃棒,使溶质全部转移到容量瓶中;
(6)定容后还需要上下颠倒摇匀;
(7)盛放溶液的标签需要注明溶液名称及物质的量浓度;
(8)加水如果超过刻度线,此次配制失败,需要重新配制;
(9)根据c=
可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.
(2)根据m=cVM计算配制1000mL 0.1mol/L CuSO4溶液需要胆矾的质量;
(4)通过玻璃棒的搅拌可以加速硫酸铜的溶解;
(5)转移溶液时,通过玻璃棒引流,可以避免溶解的硫酸铜流到容量瓶以外;还需要洗涤烧杯和玻璃棒,使溶质全部转移到容量瓶中;
(6)定容后还需要上下颠倒摇匀;
(7)盛放溶液的标签需要注明溶液名称及物质的量浓度;
(8)加水如果超过刻度线,此次配制失败,需要重新配制;
(9)根据c=
| n |
| V |
解答:
解:(1)配制980mL的溶液,需要选用规格为1000mL的容量瓶,实际上配制的是1000mL 0.1mol/L的硫酸铜溶液,实验操作的步骤为:计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,该实验中需要用天平称量、用药匙取药品,烧杯溶解药品,需要玻璃棒搅拌和引流,需要1000mL容量瓶配制溶液,需要胶头滴管定容,还缺少的仪器为1000mL容量瓶、胶头滴管,
故答案为:1000mL容量瓶;胶头滴管;
(2)配制1000mL 0.1mol/L CuSO4溶液,需要胆矾的质量为:250g/mol×0.1mol/L×1L=25.0g,
故答案为:25.0;
(4)溶解胆矾时,需要使用玻璃棒搅拌,加速硫酸铜的溶解,
故答案为:搅拌,加速CuSO4溶解;
(5)转移溶液的硫酸铜溶液时,通过玻璃棒的引流,可以避免硫酸铜溶液流到容量瓶以外;通过洗涤烧杯和玻璃棒,可以保证溶质全部转移入容量瓶中,
故答案为:玻璃棒;保证溶质全部转移入容量瓶中;
(6)待容量瓶中溶液的凹液面正好与刻度线相切,盖好瓶塞后上下颠倒摇匀,
故答案为:上下颠倒摇匀;
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,标签需要注明溶液名称、浓度,即: ,
,
故答案为: ;
;
(8)定容时,若加入的水超过刻度线,此次配制失败,需要倒掉重新配制,
故答案为:重新配制;
(9)①转移溶液后,未洗涤烧杯,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,
故答案为:偏低;
②容量瓶用水洗净后未烘干,对溶质的物质的量及溶液的最终体积都没有影响,所以不影响配制结果,
故答案为:无影响;
③定容时俯视容量瓶的刻度线,导致加入的蒸馏水体积偏小,配制的溶液体积偏小,溶液浓度偏高,
故答案为:偏高.
故答案为:1000mL容量瓶;胶头滴管;
(2)配制1000mL 0.1mol/L CuSO4溶液,需要胆矾的质量为:250g/mol×0.1mol/L×1L=25.0g,
故答案为:25.0;
(4)溶解胆矾时,需要使用玻璃棒搅拌,加速硫酸铜的溶解,
故答案为:搅拌,加速CuSO4溶解;
(5)转移溶液的硫酸铜溶液时,通过玻璃棒的引流,可以避免硫酸铜溶液流到容量瓶以外;通过洗涤烧杯和玻璃棒,可以保证溶质全部转移入容量瓶中,
故答案为:玻璃棒;保证溶质全部转移入容量瓶中;
(6)待容量瓶中溶液的凹液面正好与刻度线相切,盖好瓶塞后上下颠倒摇匀,
故答案为:上下颠倒摇匀;
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,标签需要注明溶液名称、浓度,即:
 ,
,故答案为:
 ;
;(8)定容时,若加入的水超过刻度线,此次配制失败,需要倒掉重新配制,
故答案为:重新配制;
(9)①转移溶液后,未洗涤烧杯,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,
故答案为:偏低;
②容量瓶用水洗净后未烘干,对溶质的物质的量及溶液的最终体积都没有影响,所以不影响配制结果,
故答案为:无影响;
③定容时俯视容量瓶的刻度线,导致加入的蒸馏水体积偏小,配制的溶液体积偏小,溶液浓度偏高,
故答案为:偏高.
点评:本题考查了配制一定物质的量浓度的溶液的方法,题目难度中等,试题基础性强,难易适中,注重灵活性,注意掌握配制一定物质的量难度的溶液方法,试题有利于培养学生的逻辑思维能力和严谨的规范实验操作能力.

练习册系列答案
相关题目
2005年1月,美国科学家在《Science》上发表论文,宣布发现Al的超原子结构,如Al13、Al14,并用质谱仪检测到稳定的Al13I--等,Al13、Al14的一些性质像其它的主族元素的化学性质,得到或失去电子生成40个价电子的最稳定状态.下列说法中不正确的是( )
| A、Al13与卤族单质的性质相似 |
| B、Al14与第IIA族元素的性质相似 |
| C、Al13在一定条件下与HI反应的化学方程式:Al13+HI=HAl13I. |
| D、Al14中的Al原子间以离子键相结合 |
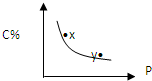 对于mA(s)+nB(g)?pC(g)的可逆反应,在一定温度下C的百分含量与压强的关系如图所示,则下列判断正确的是( )
对于mA(s)+nB(g)?pC(g)的可逆反应,在一定温度下C的百分含量与压强的关系如图所示,则下列判断正确的是( )| A、m+n<p |
| B、n>p |
| C、x点的状态是v正>v逆 |
| D、y点的状态是v正<v逆 |