题目内容
4.下列有关实验的描述不正确的是( )| A. | 钠在空气和氯气中燃烧,火焰皆呈黄色,但生成固体颜色不同 | |
| B. | 新制饱和氯水和浓硝酸光照下会有气体产生,其成分中有氧气 | |
| C. | 次氯酸和过氧化钠都能使品红溶液褪色,其原理是不相同的 | |
| D. | Mg在CO2中燃烧生成MgO和C,在该反应条件下,Mg的还原性强于C的还原性 |
分析 A.钠与氯气发生反应生成氯化钠,为白色固体,火焰呈黄色;
B.氯水中含有次氯酸,分解生成氧气,硝酸不稳定,分解生成二氧化氮和氧气;
C.次氯酸和过氧化钠都具有强氧化性;
D.根据还原剂还原性大于还原产物判断.
解答 解:A.钠与氯气发生反应生成氯化钠,为白色固体,火焰呈黄色,颜色不同,故A正确;
B.氯水中含有次氯酸,分解生成氧气,硝酸不稳定,分解生成二氧化氮和氧气,故B正确;
C.次氯酸和过氧化钠都具有强氧化性,可使品红褪色,原理相同,故C错误;
D.还原剂还原性大于还原产物,可知Mg的还原性强于C的还原性,故D正确.
故选C.
点评 本题综合考查钠、氯气等知识,为高频考点,侧重于双基的考查,注意把握物质的性质,注意相关基础知识的积累,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.2015年10月,宁波籍科学家屠呦呦获得诺贝尔生理学或医学奖,她成为首获科学类诺贝尔奖的中国本土科学家.她获奖的原因是发现了( )
| A. | 青蒿素 | B. | 青霉素 | C. | 虾青素 | D. | 维生素 |
19.已知:常温下,1.5mol/L H2SO4溶液的密度为ρ1 g/mL,1mol/L NaOH溶液的密度为ρ2 g/mL.现将V1 mL 1.5mol/L H2SO4溶液与V2 mL 1mol/L NaOH溶液混合,所得混合液呈碱性,测得混合液的密度为ρ3 g/mL.则混合溶液中c(H+)为(单位:mol/L)( )
| A. | $\frac{3{V}_{1}-{V}_{2}}{{V}_{1}+{V}_{2}}$ | |
| B. | $\frac{({V}_{1}+{V}_{2})×1{0}^{-14}}{{V}_{2}-3{V}_{1}}$ | |
| C. | $\frac{({V}_{1}{P}_{1}+{V}_{2}{P}_{2})×1{0}^{-14}}{({V}_{2}-3{V}_{1}){P}_{3}}$ | |
| D. | $\frac{({V}_{1}{P}_{1}+{V}_{2}{P}_{2})×1{0}^{-14}}{(3{V}_{1}-{V}_{2}){P}_{3}}$ |
9.下列化合物的核磁共振氢谱中出现三组峰的是( )
| A. | 异戊烷 | B. | 异戊二烯 | C. | 邻二甲苯 | D. | 萘 |
13.下列各表述与示意图一致的是( )
| A. | 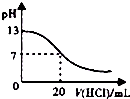 如图表示室温时,用0.1 mol.L-1 盐酸滴定0.1 mol•L-1NaOH溶液过程中的pH变化 | |
| B. | 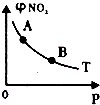 T℃时,反应2NO2(g)  N2O4(g)达到平衡时NO2的体积分数φ(NO2)随压强P的变化如图所示,则A点的颜色深,B点的颜色浅 N2O4(g)达到平衡时NO2的体积分数φ(NO2)随压强P的变化如图所示,则A点的颜色深,B点的颜色浅 | |
| C. | 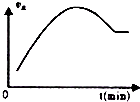 如图表示向绝热恒容密闭容器中通入A2和B2,一定条件下使反应2A2(g)+B2(g)?2C(g)达到平衡,正反应速率随时间变化的示意图.由图可得出的结论是:反应物的总能量低于生成物的总量 | |
| D. | 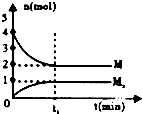 如图在恒温恒容的密闭容器中,气体M存在如下关系xM(g)?Mx(g),t1时刻,保持温度不变,再充入1mol M,重新达到平衡时$\frac{c(Mx)}{c(M)}$将增大 |
14.在标准状况下,112mL某气体的质量为0.16g,该气体可能是( )
| A. | O2 | B. | N2 | C. | H2S | D. | CO2 |
 开发新能源,使用清洁燃料,可以达到减少污染的目的.
开发新能源,使用清洁燃料,可以达到减少污染的目的.