题目内容
12. 开发新能源,使用清洁燃料,可以达到减少污染的目的.
开发新能源,使用清洁燃料,可以达到减少污染的目的.(1)由C、H、O三种元素中的两种和三种分别组成的燃料物质甲和乙,其分子中均有氧,且1个乙分子中含有18个电子,则甲和乙分别是CO、CH3OH.乙是一种清洁燃料,工业上可用甲和氢气反应制得.
①T1温度时,在体积为2L的密闭容器中充入2mol甲和6mol H2,反应达到平衡后,测得c(甲)=0.2mol/L,则乙在平衡混合物中的物质的量分数是0.33.(保留两位有效数字)
②升高温度到T2时,反应的平衡常数为1,下列措施可以提高甲的转化率的是C(填字母).
A.加入2mol甲 B.充入氮气 C.分离出乙 D.升高温度
(2)甲烷也是一种清洁燃料,但不完全燃烧时热效率降低并会产生有毒气体造成污染.已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-890.3kJ/mol
2CO(g)+O2(g)═2CO2(g)△H2=-566.0kJ/mol
则甲烷不完全燃烧生成一氧化碳和液态水时的热效率是完全燃烧时的0.7倍(计算结果保留1位小数).
(3)甲烷燃料电池可以提升能量利用率.右图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图(O2-可以在固态电解质中自由移动).请回答:
①甲烷燃料电池的负极反应式是CH4-8e-+4O2-=CO2+2H2O.
②当线路中有0.1mol电子通过时,b(填“a”或“b”)极增重3.2g.
分析 (1)由C、H、O三种元素中的两种和三种分别组成的燃料物质甲和乙,其分子中均有氧,且1个乙分子中含有18个电子,则甲为CO、乙为CH3OH.
①反应达到平衡后,测得c(甲)=0.2mol/L,CO为2L×0.2mol/L=0.4mol,则:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol):2 6 0
转化量(mol):1.6 3.2 1.6
平衡量(mol):0.4 2.8 1.6
甲醇物质的量分数=$\frac{甲醇物质的量}{混合气体总物质的量}$;
②温度T1时平衡常数K=$\frac{\frac{1.6}{2}}{\frac{0.4}{2}×(\frac{2.8}{2})^{2}}$=2.04,升高温度到T2时,反应的平衡常数为1,平衡常数减小,说明升高温度平衡逆向移动,正反应为放热反应.
A.加入2mol甲,甲的转化率降低;
B.恒温恒容下,充入氮气,平衡不移动;
C.分离出乙,平衡正向移动;
D.升高温度平衡逆向移动;
(2)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
根据盖斯定律,①×2-②得到:2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H=-1214.6kJ/mol,
再计算1mol甲烷不完全燃烧、完全燃烧发生热量,可得热效率关系;
(3)①负极发生氧化反应,甲烷在负极失去电子,与通过固体电解质的氧离子结合生成二氧化碳与水;
②B为电解池,铜离子发生还原反应,在阴极上析出,该极连接原电池的负极,根据转移电子计算生成Cu的物质的量,再根据m=nM计算生成Cu的质量.
解答 解:(1)由C、H、O三种元素中的两种和三种分别组成的燃料物质甲和乙,其分子中均有氧,且1个乙分子中含有18个电子,则甲为CO、乙为CH3OH,故答案为:CO、CH3OH;
①反应达到平衡后,测得c(甲)=0.2mol/L,CO为2L×0.2mol/L=0.4mol,则:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol):2 6 0
转化量(mol):1.6 3.2 1.6
平衡量(mol):0.4 2.8 1.6
甲醇物质的量分数=$\frac{1.6mol}{4.8mol}$=0.33,故答案为:0.33;
②温度T1时平衡常数K=$\frac{\frac{1.6}{2}}{\frac{0.4}{2}×(\frac{2.8}{2})^{2}}$=2.04,升高温度到T2时,反应的平衡常数为1,平衡常数减小,说明升高温度平衡逆向移动,正反应为放热反应.
A.加入2molCO,CO的转化率降低,故A错误;
B.恒温恒容下,充入氮气,各组分浓度不变,平衡不移动,CO转化率不变,故B错误;
C.分离出乙,平衡正向移动,CO的转化率增大,故C正确;
D.升高温度平衡逆向移动,CO的转化率减小,故D错误,
故选:C;
(2)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
根据盖斯定律,①×2-②得到:2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H=-1214.6kJ/mol,
1mol甲烷不完全燃烧的热效率是完全燃烧的$\frac{\frac{1214.6kJ}{2}}{890.3kJ}$=0.7倍,
故答案为:0.7;
(3)①负极发生氧化反应,甲烷在负极失去电子,与通过固体电解质的氧离子结合生成二氧化碳与水,负极电极反应式为:CH4-8e-+4O2-=CO2+2H2O,故答案为:CH4-8e-+4O2-=CO2+2H2O;
②B为电解池,铜离子发生还原反应,在阴极析出,该极连接原电池的负极,故在b电极析出Cu,b电极的质量增重,转移0.1mol电子,析出铜的物质的量为$\frac{0.1mol}{2}$=0.05mol,故析出铜的质量为0.05mol×64g/mol=3.2g,
故答案为:b; 3.2.
点评 本题比较综合,涉及化学平衡计算、盖斯定律应用、电化学基础等,注意电化学计算中电子转移守恒应用,难度中等.

| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系 能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
| A. | 容器②中达平衡时放出的热量Q=23.15 kJ | |
| B. | 平衡时,两个容器中NH3的体积分数均为$\frac{1}{7}$ | |
| C. | 容器①、②中反应的平衡常数相等 | |
| D. | 若容器①体积为0.5L,则平衡时放出的热量<23.15kJ |
①氯化钙溶液 ②澄清的石灰水 ③碳酸钠溶液
④偏铝酸钠溶液 ⑤硅酸钠溶液 ⑥次氯酸钙溶液.
| A. | ①②④⑤⑥ | B. | ②③④⑤⑥ | C. | ④⑤ | D. | ③④⑤ |
| A. | 钠在空气和氯气中燃烧,火焰皆呈黄色,但生成固体颜色不同 | |
| B. | 新制饱和氯水和浓硝酸光照下会有气体产生,其成分中有氧气 | |
| C. | 次氯酸和过氧化钠都能使品红溶液褪色,其原理是不相同的 | |
| D. | Mg在CO2中燃烧生成MgO和C,在该反应条件下,Mg的还原性强于C的还原性 |
| A. | 胶体区别于其他分散系的本质依据是具有丁达尔效应 | |
| B. | 通电时,溶液中的溶质粒子分别向两极移动,胶体粒子也一定会向某一极移动 | |
| C. | 纳米材料粒子直径一般在10-9m与10-7m之间,因此纳米材料属于胶体 | |
| D. | 在江河入海处容易形成沙洲与胶体的聚沉有关 |
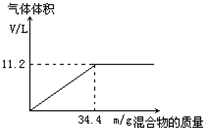 在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应.如图表示加入的混合物的质量与产生的气体体积(标准状况)的关系.
在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应.如图表示加入的混合物的质量与产生的气体体积(标准状况)的关系.

