题目内容
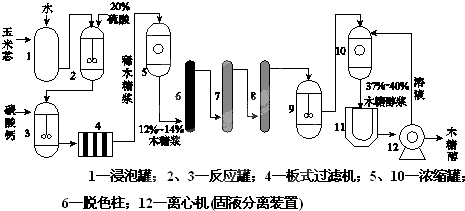
木糖醇(C5H12O5)可用作甜味剂、营养剂,在化工、食品、医药等工业中有广泛应用.利用玉米芯中的多糖可以生产木糖醇,其工艺流程如下:
已知:木糖与木糖醇的转化关系如右:
请回答下列问题:
(1)装置2中硫酸的主要作用是 .
(2)装置3中加入碳酸钙的目的是 .
(3)为除去木糖浆中的杂质离子,7、8装置中的填充物依次是 .
(4)装置9的作用是 .
A.冷却木糖浆 B.水解木糖 C.氧化木糖 D.还原木糖
(5)装置11的作用是 .

已知:木糖与木糖醇的转化关系如右:

请回答下列问题:
(1)装置2中硫酸的主要作用是
(2)装置3中加入碳酸钙的目的是
(3)为除去木糖浆中的杂质离子,7、8装置中的填充物依次是
(4)装置9的作用是
A.冷却木糖浆 B.水解木糖 C.氧化木糖 D.还原木糖
(5)装置11的作用是
考点:制备实验方案的设计
专题:糖类与蛋白质专题
分析:根据题中利用玉米芯中的多糖生产木糖醇的流程可知,玉米芯在酸性条件下水解得木糖浆,木糖浆经过用碳酸钙、离子交换膜等过程除杂,得较纯的木糖浆,木糖浆再还原得木糖醇,然后通过结晶得木糖醇,
(1)玉米蕊在硫酸作催化剂的条件下发生水解;
(2)装置2中的硫酸流到装置3中,加入碳酸钙可以除去混合物中的硫酸;
(3)木糖浆中的杂质离子,可以通过阳离子交换膜和阴离子交换膜除去;
(4)玉米蕊水解得到的是木糖为多羟基醛,通过装置9可将醛基还原成羟基;
(5)装置11的作用是将37%-40%木糖醇浆得到木糖醇,可以通过结晶的方法.
(1)玉米蕊在硫酸作催化剂的条件下发生水解;
(2)装置2中的硫酸流到装置3中,加入碳酸钙可以除去混合物中的硫酸;
(3)木糖浆中的杂质离子,可以通过阳离子交换膜和阴离子交换膜除去;
(4)玉米蕊水解得到的是木糖为多羟基醛,通过装置9可将醛基还原成羟基;
(5)装置11的作用是将37%-40%木糖醇浆得到木糖醇,可以通过结晶的方法.
解答:
解:根据题中利用玉米芯中的多糖生产木糖醇的流程可知,玉米芯在酸性条件下水解得木糖浆,木糖浆经过用碳酸钙、离子交换膜等过程除杂,得较纯的木糖浆,木糖浆再还原得木糖醇,然后通过结晶得木糖醇,
(1)玉米蕊在硫酸作催化剂的条件下发生水解,故答案为:催化;
(2)装置2中的硫酸流到装置3中,加入碳酸钙可以除去混合物中的硫酸,生成硫酸钙有利于分离,
故答案为:中和剩余的硫酸,生成硫酸钙有利于分离;
(3)木糖浆中的杂质离子,可以通过阳离子交换膜和阴离子交换膜除去,
故答案为:阳离子交换膜、阴离子交换膜;
(4)玉米蕊水解得到的是木糖为多羟基醛,通过装置9可将醛基还原成羟基,故选D;
(5)装置11的作用是将37%-40%木糖醇浆得到木糖醇,可以通过结晶的方法,故答案为:结晶.
(1)玉米蕊在硫酸作催化剂的条件下发生水解,故答案为:催化;
(2)装置2中的硫酸流到装置3中,加入碳酸钙可以除去混合物中的硫酸,生成硫酸钙有利于分离,
故答案为:中和剩余的硫酸,生成硫酸钙有利于分离;
(3)木糖浆中的杂质离子,可以通过阳离子交换膜和阴离子交换膜除去,
故答案为:阳离子交换膜、阴离子交换膜;
(4)玉米蕊水解得到的是木糖为多羟基醛,通过装置9可将醛基还原成羟基,故选D;
(5)装置11的作用是将37%-40%木糖醇浆得到木糖醇,可以通过结晶的方法,故答案为:结晶.
点评:本题主要考查木糖醇的制备,中等难度,答题时注意对制备原理和工业流程的理解.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
下列有关热化学方程式或反应热的说法正确的是( )
A、已知:H2(g)+
| ||||
| B、已知:S(g)+O2(g)=SO2(g)△H1=-Q1;S(s)+O2(g)=SO2(g)△H2=-Q2(Q1、Q2均正值),则Q1<Q2 | ||||
C、已知:
| ||||
D、已知:Fe2O3(s)+3C(石墨,s)=2Fe(s)+3CO(g)△H=+489.0 kJ?mol-1;CO(g)+
|
取Fe和Fe2O3的混合物15g,加入150mL 2mol/L的稀硫酸,固体混合物完全溶解,放出气体1.68L(标准状况下),向所得溶液中滴入硫氰化钾溶液,未见颜色变化.若要使该溶液中的铁元素完全转化为沉淀,需加入3mol/L的NaOH溶液的体积为( )
| A、150 mL |
| B、200 mL |
| C、225 mL |
| D、250 mL |
下列说法正确的是( )
| A、已知:N2(g)+2O2(g)=2NO2(g)△H=+68kJ?mol-12C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1则4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=+1200kJ?mol-1 | ||||||||||||
| B、由H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ?mol-1,则向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ | ||||||||||||
C、通常人们把拆开1 mol气态物质中某种共价键需要吸收的能量看成该共价键的键能
| ||||||||||||
| D、NH4HCO3(s)═NH3 (g)+H2O(g)+CO2(g)△H=+185.57 kJ?mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
现在铁与另一种金属组成的混合物1.2g,与足量稀硫酸反应生成H2 0.1g,则混合物中的另一种金属可能是( )
| A、Mg | B、Al | C、Zn | D、Cu |
一定温度下,在密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如下表,下列说法不正确的是( )
| 物质 | X | Y | Z | W |
| 初始浓度/mol?L-1 | 0.5 | 0.5 | 0 | 0 |
| 平衡浓度/mol?L-1 | 0.1 | 0.1 | 0.4 | 0.4 |
| A、反应达到平衡时,X的体积分数为10% |
| B、该温度下反应的平衡常数K=16 |
| C、保持温度不变增大压强,反应速率加快,平衡向正反应方向移动 |
| D、若X、Y的初始浓度均为0.8 mol?L-1,相同条件下达到平衡,W的浓度为0.64 mol?L-1 |
 某学生设计如下实验装置利用氯气与消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
某学生设计如下实验装置利用氯气与消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题: