题目内容
11.常温下,分别将四块形状相同,质量均为6g的铁块同时投入下列四种溶液中,产生氢气气体速率最快的是( )| A. | 200mL 2mol/L HCl | B. | 500mL 2mol/L H2SO4 | ||
| C. | 100mL 3mol/L HNO3 | D. | 500mL 18.4mol/L H2SO4 |
分析 质量为9g的铁块同时投入下列四种溶液中,产生氢气速率最快的溶液中氢离子浓度最大,铁与硝酸、浓硫酸不生成氢气,以此来解答.
解答 解:A.200mL 2mol/L HCl的盐酸中H+离子为2mol/L;
B.500mL 2mol•L-1的硫酸中H+离子为4mol/L;
C.铁与稀硝酸反应得不到H2;
D.铁与18.4mol•L-1的浓硫酸发生钝化;
所以,铁与500mL 2mol•L-1的硫酸反应产生H2速率最快最快.
故选:B
点评 本题主要考查了影响化学反应速率的因素,为高频考点,难度不大,易错选项是D,注意并不是浓度越大,化学反应速率越大,如D选项,因发生钝化现象而阻止反应发生,同时注意铁与稀硝酸反应得不到H2.

练习册系列答案
相关题目
1.温度为T时,在4.0L恒容密闭容器中充入2.0mol PCl5,发生反应:PCl5(g)?PCl3(g)+Cl2(g),反应时间(t)与容器内气体总压强(p)的数据见表:
(1)由总压强p和起始压强p0计算反应物PCl5的转化率α(PCl5)的表达式为?平衡时PCl5的转化率为多少?
(2)反应在前50s的平均速率v(PCl3)为多少?
(3)该温度下的平衡常数为多少?
| t/s | 0 | 50 | 150 | 250 | 350 |
| 总压强p/100kPa | 100 | 116 | 119 | 120 | 120 |
(2)反应在前50s的平均速率v(PCl3)为多少?
(3)该温度下的平衡常数为多少?
2.下列有关胶体的说法错误的是( )
| A. | 分散质粒子大小介于10-9 m~10-7m之间的分散系称为胶体 | |
| B. | 电泳现象可证明胶体粒子带有电荷 | |
| C. | 用聚光手电筒照射NaCl溶液和Fe(OH)3胶体时,产生的现象不相同 | |
| D. | 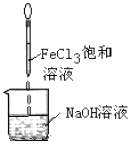 Fe(OH)3难溶于水,因此可以用如图的方法制备Fe(OH)3胶体 |
6.下列说法正确的是( )
①铁在潮湿空气中生锈是自发过程
②NH4HCO3受热分解是熵增的过程
③反应焓变是决定反应能否自发进行的唯一因素
④自发过程中,熵值都是增大的
⑤温度、压强一定时,放热且熵增加的反应一定能自发进行.
①铁在潮湿空气中生锈是自发过程
②NH4HCO3受热分解是熵增的过程
③反应焓变是决定反应能否自发进行的唯一因素
④自发过程中,熵值都是增大的
⑤温度、压强一定时,放热且熵增加的反应一定能自发进行.
| A. | ①②③④⑤ | B. | ①②⑤ | C. | ③④ | D. | ④⑤ |
16.下列化学反应,能用离子方程式Ba2++SO42-═BaSO4↓表示的是( )
| A. | 硫酸溶液与氢氧化钡溶液 | B. | 氯化钡溶液与硫酸钾溶液 | ||
| C. | 碳酸钡与稀硫酸 | D. | 氢氧化钡溶液与硫酸铜溶液 |
3.0.1mol/L的K2S溶液中,有关粒子的浓度大小关系正确的是( )
| A. | c(K+)+c(H+)=c(S2-)+c(HS-)+c(OH-) | B. | c(K+)+c(S2-)=0.3mol/L | ||
| C. | c(K+)=2[c(S2-)+c(HS-)+c(H2S)] | D. | c(OH-)=c(H+)+c(HS-)+c(H2S) |
20.用98%,密度为1.84g/cm3的浓硫酸配制1mol/L的稀硫酸100mL,配制过程中需要用到的仪器及使用的先后顺序排列正确的是( )
①100mL量筒 ②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100mL 容量瓶⑥胶头滴管 ⑦玻璃棒.
①100mL量筒 ②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100mL 容量瓶⑥胶头滴管 ⑦玻璃棒.
| A. | ②⑥⑤⑦⑥ | B. | ④⑥③⑦⑤⑥ | C. | ②⑥③⑦⑤⑥ | D. | ①⑥③⑤⑥⑦ |
20.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如图变化规律(图中a表示转化率,φ表示体积分数,p表示压强,T表示温度,n表示物质的量),根据以上规律图象,下列总结的反应特点结论不全面的是( )
| A. | 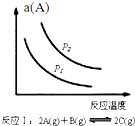 如图反应:△H<0,P2>P1 | |
| B. |  如图反应:△H<0,T1>T2 | |
| C. |  如图反应:△H>0,T2>T1 | |
| D. |  如图反应:△H>0,T2>T1或△H<0,T2<T1 |