题目内容
1.苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式为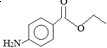 .下列关于苯佐卡因的叙述正确的是( )
.下列关于苯佐卡因的叙述正确的是( )| A. | 分子中含有3种官能团 | |
| B. | 1 mol该化合物最多与4 mol氢气发生加成反应 | |
| C. | 苯环上有2个取代基,且含有硝基的同分异构体有15种 | |
| D. | 分子式为C9H10NO2 |
分析 A.分子中含有氨基、酯基;
B.苯环与氢气发生加成反应;
C.两个取代基为-NO2、正丙基,或者-NO2、异丙基,或者为-CH2NO2、乙基,或者-CH2CH2NO2、-CH3,或者-CH(CH3)NO2、-CH3,各有邻、间、对3种;
D.根据结构简式可以确定分子式.
解答 解:A.含有氨基、酯基2种官能团,故A错误;
B.只有苯环能和氢气发生加成反应,所以1 mol该化合物最多与3mol氢气发生加成反应,故B错误;
C.两个取代基为-NO2、正丙基,或者-NO2、异丙基,或者为-CH2NO2、乙基,或者-CH2CH2NO2、-CH3,或者-CH(CH3)NO2、-CH3,各有邻、间、对3种,故符合条件的同分异构体共有15种,故C正确;
D.根据结构简式确定分子式为C9H11NO2,故D错误.
故选C.
点评 本题考查有机物的结构和性质、限制条件同分异构体的书写等,侧重于学生的分析能力的考查,注意把握有机物的结构特征和官能团的性质,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列关于物质性质变化的比较,不正确的是( )
| A. | 酸性强弱:HClO4>H2SO4>H3PO4>H2SiO3 | |
| B. | 原子半径大小:K>Na>S>O | |
| C. | 熔沸点高低:金刚石>NaCl>H2O>H2 | |
| D. | 还原性强弱:F->Cl->Br->I- |
5.下列各组中的反应,属于同一反应类型的是( )
| A. | 氯乙烷水解制乙醇;丙烯与氯化氢反应 | |
| B. | 乙酸和乙醇制乙酸乙酯;苯与液溴的反应 | |
| C. | 2-氯丙烷制丙烯;由乙炔与溴的反应 | |
| D. | 氯乙烯制聚氯乙烯;由苯乙酸甲酯的水解 |
9.研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是( )
| A. | 正极反应式:Ag+Cl--e-=AgCl | |
| B. | 每生成1mol Na2Mn5O10转移2mol电子 | |
| C. | Na+不断向“水”电池的负极移动 | |
| D. | 若用阳离子交换膜,当电路中转移0.2mole-,负极区将减少0.4mol离子 |
16.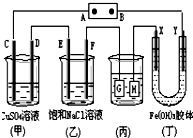 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )
 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )| A. | 电源B极是正极 | |
| B. | 装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷 | |
| C. | 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| D. | (甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2 |
6.既能溶于盐酸,又能溶于NaOH溶液的是( )
| A. | Si | B. | Mg | C. | MgO | D. | Al2O3 |
13.铝热反应是铝的一个重要性质.某校化学兴趣小组同学,取磁性氧化铁在如图1验装置进行铝热反应,冷却后得到“铁块”混合物.
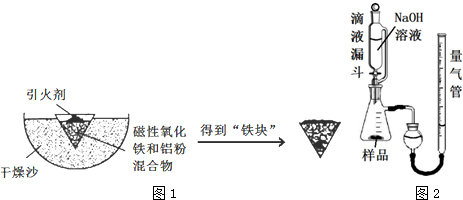
(1)取反应后的“铁块”研碎取样称量,加入如图2置滴入足量NaOH溶液充分反应,测量生成气体体积.试回答下列问题:
①该实验的实验目的是:测量样品中铝的百分含量(填物质名称).
②量气管的量具部分是一个中学实验常见量具改装而成,该仪器的名称为碱式滴定管.
③量气管在读数时调节左右管液面相平之前的步骤是恢复到室温
④装置中使用带平衡管的滴液漏斗代替普通分液漏斗,除了可以平衡压强让液体顺利滴入锥形瓶之外还可以起到降低实验误差的作用.如果装置使用分液漏斗,测量出的该物质百分含量将会
偏大(填“偏大”或“偏小”).
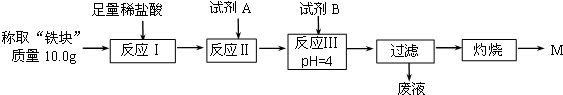
(2)另称取“铁块”样品溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图所示.
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示.
[]
①试剂A应选择C,试剂B应选择D.(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
③若最终红色粉未M的质量为12.0g,则该“铁块”中铁的百分含量是84%.

(1)取反应后的“铁块”研碎取样称量,加入如图2置滴入足量NaOH溶液充分反应,测量生成气体体积.试回答下列问题:
①该实验的实验目的是:测量样品中铝的百分含量(填物质名称).
②量气管的量具部分是一个中学实验常见量具改装而成,该仪器的名称为碱式滴定管.
③量气管在读数时调节左右管液面相平之前的步骤是恢复到室温
④装置中使用带平衡管的滴液漏斗代替普通分液漏斗,除了可以平衡压强让液体顺利滴入锥形瓶之外还可以起到降低实验误差的作用.如果装置使用分液漏斗,测量出的该物质百分含量将会
偏大(填“偏大”或“偏小”).
(2)另称取“铁块”样品溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图所示.

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示.
[]
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
③若最终红色粉未M的质量为12.0g,则该“铁块”中铁的百分含量是84%.
10.在2A+B?3C+4D中,表示该反应速率最快的是( )
| A. | υ(A)=0.5mol•L-1•S-1 | B. | υ(B)=0.3 mol•L-1•S-1 | ||
| C. | υ(C)=0.8mol•L-1•S-1 | D. | υ(D)=6 mol•L-1•min-1 |