题目内容
4. 实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验;请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验;请完成下列填空:(1)配制100mL0.10mol•L-1NaOH标准溶液.
①配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、100mL容量瓶、胶头滴管等.
②称取0.4g氢氧化钠固体所需仪器有天平(带砝码、镊子)、药匙、烧杯.
(2)取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用碱式滴定管(填仪器名称)装配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
| 滴定次数 | 待测盐酸的体积(mL) | 标准NaOH溶液体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 20.00 | 0.40 | 20.50 |
| 第二次 | 20.00 | 4.10 | 24.00 |
| 第三次 | 20.00 | 1.00 | 24.00 |
②根据上述数据,可计算出该盐酸的浓度约为0.10 mol/L(保留小数点后二位数).
③给润洗后的滴定管中注入溶液时应C(填序号)
A.借助于漏斗 B.借助于玻璃棒 C.借助于烧杯 D.直接注入
④排去碱式滴定管中气泡的方法应采用下图操作丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
⑤在上述实验中,下列操作(其他操作正确)会造成测定结果偏低的有AD
D.滴定终点读数时俯视读
A.酸式滴定管使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失.
分析 (1)①配制100mL0.10mol•L-1NaOH标准溶液需要的玻璃仪器有烧杯、量筒、玻璃棒、100mL容量瓶、胶头滴管等;
②根据m=nM计算质量;称取氢氧化钠固体所需仪器有天平(带砝码、镊子)、药匙、烧杯;
(2)装配制的标准NaOH溶液用碱式滴定管;
(3)①滴加2~3滴酚酞溶液作指示剂,最后一滴NaOH溶液加入时,溶液颜色恰好由无色变为(浅)红色,且半分钟内颜色不再改变,说明达到终点;
②根据c(酸)×V(酸)=c(碱)×V(碱)计算;
③给润洗后的滴定管中注入溶液时应借助于烧杯;
④碱式滴定管的气泡通常在橡皮管内,只要将滴定玻璃头朝上,并挤橡皮管中的玻璃珠就可以将气泡冲排出;
⑤根据c(待)=$\frac{c(标)×V(标)}{V(待)}$分析误差.
解答 解:(1)①配制100mL0.10mol•L-1NaOH标准溶液需要的玻璃仪器有烧杯、量筒、玻璃棒、100mL容量瓶、胶头滴管等,
故答案为;100mL容量瓶、胶头滴管;
②氢氧化钠的质量为m=nM=0.10L×0.10moL/L×40g/mol=0.4g;称取氢氧化钠固体所需仪器有天平(带砝码、镊子)、药匙、烧杯,
故答案为:0.4;烧杯;
(2)装配制的标准NaOH溶液用碱式滴定管,
故答案为:碱式滴定管;
(3)①滴加2~3滴酚酞溶液作指示剂,最后一滴NaOH溶液加入时,溶液颜色恰好由无色变为(浅)红色,且半分钟内颜色不再改变,说明达到终点,
故答案为:最后一滴NaOH溶液加入时,溶液颜色恰好由无色变为(浅)红色,且半分钟内颜色不再改变,说明达到终点;
②根据c(酸)×V(酸)=c(碱)×V(碱),3次实验所用V(NaOH)分别是20.10mL、19.90mL、23.00mL,第3次实验数据误差较大,舍去,则前2次V(NaOH)的平均值为20.00mL,则该盐酸的浓度为$\frac{20.00mL×0.10mol/L}{20.00mL}$=0.10mol/L,
故答案为:0.10;
③给润洗后的滴定管中注入溶液时应借助于烧杯,
故答案为:C;
④碱式滴定管的气泡通常在橡皮管内,只要将滴定玻璃头朝上,并挤橡皮管中的玻璃珠就可以将气泡冲排出,
故答案为:丙;
⑤A.酸式滴定管水洗后未用待测稀盐酸溶液润洗,会导致盐酸浓度偏小,需要NaOH体积偏小,测定值偏小,故A正确;
B.锥形瓶水洗后后未干燥,对实验无影响,故B错误;
C.称量NaOH固体中混有Na2CO3固体,等质量的碳酸钠和氢氧化钠,碳酸钠消耗的盐酸偏低,在滴定时消耗的标准液体积偏大,测定结果偏高,故C错误;
D.滴定到达终点时,俯视读出滴定管读数,会导致NaOH体积偏小,测定溶液浓度偏小,故D正确;
E.碱式滴定管尖嘴部分有气泡,滴定后消失,会导致测定NaOH体积偏大,测定值偏大,故E错误;
故答案为:AD.
点评 本题考查中和滴定操作,题目难度中等,注意把握实验基本方法,能会分析导致误差的不当操作,注意把握实验操作要点和注意事项.

 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案| A. | 氯乙烷水解制乙醇;丙烯与氯化氢反应 | |
| B. | 乙酸和乙醇制乙酸乙酯;苯与液溴的反应 | |
| C. | 2-氯丙烷制丙烯;由乙炔与溴的反应 | |
| D. | 氯乙烯制聚氯乙烯;由苯乙酸甲酯的水解 |
| A. | 正极反应式:Ag+Cl--e-=AgCl | |
| B. | 每生成1mol Na2Mn5O10转移2mol电子 | |
| C. | Na+不断向“水”电池的负极移动 | |
| D. | 若用阳离子交换膜,当电路中转移0.2mole-,负极区将减少0.4mol离子 |
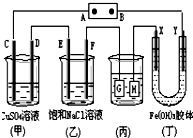 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )| A. | 电源B极是正极 | |
| B. | 装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷 | |
| C. | 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| D. | (甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2 |

(1)取反应后的“铁块”研碎取样称量,加入如图2置滴入足量NaOH溶液充分反应,测量生成气体体积.试回答下列问题:
①该实验的实验目的是:测量样品中铝的百分含量(填物质名称).
②量气管的量具部分是一个中学实验常见量具改装而成,该仪器的名称为碱式滴定管.
③量气管在读数时调节左右管液面相平之前的步骤是恢复到室温
④装置中使用带平衡管的滴液漏斗代替普通分液漏斗,除了可以平衡压强让液体顺利滴入锥形瓶之外还可以起到降低实验误差的作用.如果装置使用分液漏斗,测量出的该物质百分含量将会
偏大(填“偏大”或“偏小”).
(2)另称取“铁块”样品溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图所示.

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示.
[]
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
③若最终红色粉未M的质量为12.0g,则该“铁块”中铁的百分含量是84%.
| A. | 侯氏制碱法的基本原理:Na++NH3+H2O+CO2=NaHCO3↓+NH4+ | |
| B. | 向KAl(SO4)2溶液中加入Ba(OH)2溶液至中性:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 硫酸亚铁溶液中滴加酸化的双氧水:2Fe2++2H++H2O2=2Fe3++2H2O | |
| D. | 向漂白粉溶液中通入少量的SO2气体:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO |
 氨和硝酸都是重要的化学品.
氨和硝酸都是重要的化学品.
