题目内容
18.已知aX、bY是元素周期表中除稀有气体外的短周期元素,且a-b=3,X、Y能形成化合物M,下列说法不正确的是( )| A. | 若X和Y处于同一周期,则X的原子半径肯定小于Y的原子半径 | |
| B. | 若X和Y处于同一周期,且M属于共价化合物,则分子中原子个数比可能为1:2 | |
| C. | 若最外层电子数X>Y>2,则X的非金属性一定比Y的非金属性强 | |
| D. | 若M属于离子化合物,则该化合物中只存在离子键,且每个原子均达到8电子稳定结构 |
分析 已知aX、bY是元素周期表中除稀有气体外的短周期元素,且a-b=3,X原子序数大于Y,二者不能同主族,可能同周期,也可能不同周期,Y处于第二周期、X处于第三周期,或者Y为H元素、X为Be.
A.同周期随原子序数增大,原子半径减小;
B.若X和Y处于同一周期,且M属于共价化合物,可以为C2F4等;
C.若最外层电子数X>Y>2,二者同周期,同周期随原子序数增大,非金属性增强;
D.若M属于离子化合物,则Y为O、X为Na,或者Y为F、X为Mg.
解答 解:已知aX、bY是元素周期表中除稀有气体外的短周期元素,且a-b=3,X原子序数大于Y,二者不能同主族,可能同周期,也可能不同周期,Y处于第二周期、X处于第三周期,或者Y为H元素、X为Be.
A.若X和Y处于同一周期,同周期随原子序数增大,原子半径减小,则X的原子半径肯定小于Y的原子半径,故A正确;
B.若X和Y处于同一周期,且M属于共价化合物,可以为C2F4等,符合分子中原子个数比为1:2,故B正确;
C.若最外层电子数X>Y>2,二者同周期,同周期随原子序数增大,非金属性增强,则X的非金属性一定比Y的非金属性强,故C正确;
D.若M属于离子化合物,则Y为O、X为Na,或者Y为F、X为Mg,过氧化钠中既含有离子键又含有共价键,故D错误,
故选D.
点评 本题考查结构性质位置关系应用,为高频考点和常见题型,解答关键是明确二者位置关系及可能的元素,结合元素周期律及常见元素化合物解答,B选项为易错点,难度中等.

练习册系列答案
相关题目
1.下列做法中错误的是( )
| A. | 鱼、肉、虾等食品用福尔马林防腐保鲜 | |
| B. | 国际奥委会禁止使用的兴奋剂--麻黄碱 | |
| C. | 向伤口处涂一定浓度的双氧水溶液可以杀菌消毒 | |
| D. | 误食铜、汞、铜等重金属,立即喝牛奶或鸡蛋清解毒 |
9.研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是( )
| A. | 正极反应式:Ag+Cl--e-=AgCl | |
| B. | 每生成1mol Na2Mn5O10转移2mol电子 | |
| C. | Na+不断向“水”电池的负极移动 | |
| D. | 若用阳离子交换膜,当电路中转移0.2mole-,负极区将减少0.4mol离子 |
6.既能溶于盐酸,又能溶于NaOH溶液的是( )
| A. | Si | B. | Mg | C. | MgO | D. | Al2O3 |
13.铝热反应是铝的一个重要性质.某校化学兴趣小组同学,取磁性氧化铁在如图1验装置进行铝热反应,冷却后得到“铁块”混合物.
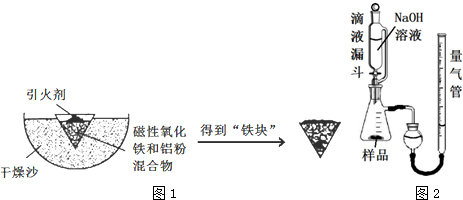
(1)取反应后的“铁块”研碎取样称量,加入如图2置滴入足量NaOH溶液充分反应,测量生成气体体积.试回答下列问题:
①该实验的实验目的是:测量样品中铝的百分含量(填物质名称).
②量气管的量具部分是一个中学实验常见量具改装而成,该仪器的名称为碱式滴定管.
③量气管在读数时调节左右管液面相平之前的步骤是恢复到室温
④装置中使用带平衡管的滴液漏斗代替普通分液漏斗,除了可以平衡压强让液体顺利滴入锥形瓶之外还可以起到降低实验误差的作用.如果装置使用分液漏斗,测量出的该物质百分含量将会
偏大(填“偏大”或“偏小”).
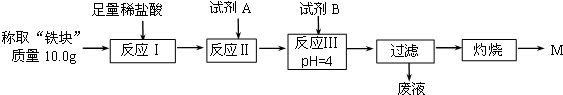
(2)另称取“铁块”样品溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图所示.
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示.
[]
①试剂A应选择C,试剂B应选择D.(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
③若最终红色粉未M的质量为12.0g,则该“铁块”中铁的百分含量是84%.

(1)取反应后的“铁块”研碎取样称量,加入如图2置滴入足量NaOH溶液充分反应,测量生成气体体积.试回答下列问题:
①该实验的实验目的是:测量样品中铝的百分含量(填物质名称).
②量气管的量具部分是一个中学实验常见量具改装而成,该仪器的名称为碱式滴定管.
③量气管在读数时调节左右管液面相平之前的步骤是恢复到室温
④装置中使用带平衡管的滴液漏斗代替普通分液漏斗,除了可以平衡压强让液体顺利滴入锥形瓶之外还可以起到降低实验误差的作用.如果装置使用分液漏斗,测量出的该物质百分含量将会
偏大(填“偏大”或“偏小”).
(2)另称取“铁块”样品溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图所示.

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示.
[]
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
③若最终红色粉未M的质量为12.0g,则该“铁块”中铁的百分含量是84%.
3.在相同条件下完全燃烧甲烷、丙烷、乙烯.如使产生的水蒸气(相同状况)的体积相等,则所需三种气体的质量比是( )
| A. | 1:2:1 | B. | 2:1:2 | C. | 4:22:7 | D. | 8:11:14 |
10.在2A+B?3C+4D中,表示该反应速率最快的是( )
| A. | υ(A)=0.5mol•L-1•S-1 | B. | υ(B)=0.3 mol•L-1•S-1 | ||
| C. | υ(C)=0.8mol•L-1•S-1 | D. | υ(D)=6 mol•L-1•min-1 |
7.将0.1mol/L的NaHC2O4溶液与0.1mol/L的NaOH溶液等体积混合后,关于该混合溶液说法不正确的是( )
| A. | 该混合溶液中有:c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+2 c(C2O42-) | |
| B. | 该混合溶液中有:c( Na+)=2[c(HC2O4-)+c(H2C2O4)+c(C2O42-)] | |
| C. | 该混合溶液中有:c(OH-)-c(H+)=c(HC2O4-)+2 c(H2C2O4) | |
| D. | 该混合溶液中有:c(Na+)>c(C2O42-)>c(HC2O4-)>c(OH-)>c(H+) |
8.据最新报道:用10B合成的10B20分子有非常好的抗癌作用.下列说法正确的是( )
| A. | 硼元素的质量数是10 | B. | 10B20具有较强的化学活性 | ||
| C. | 10B20是一种新合成的化合物 | D. | 10B的中子数与核外电子数不同 |