题目内容
7.1mol H2SO4含有NA个硫酸分子,含有2NA个氢原子,4NA个氧原子.分析 先计算出1mol硫酸分子中含有H、O原子的物质的量,然后根据N=nNA分别计算出1mol H2SO4含有含有硫酸分子、氢离子、氧原子的数目.
解答 解:1mol H2SO4中含有氢离子的物质的量为:n(H)=1mol×2=2mol,含有O原子的物质的量为:n(O)=1mol×4=4mol,
则1mol H2SO4中含有NA个硫酸分子,含有2NA个氢离子,含有4NA个氧原子,
故答案为:NA;2NA;4NA.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与阿伏伽德罗常数之间的关系即可解答,试题侧重基础知识的考查,有利于提高学生的化学计算能力.

练习册系列答案
相关题目
15.某溶液里存有NH4+Fe3+ Cu2+ Cl- SO42-离子,溶液不浑浊的是( )
| A. | CuCl2 NH4Cl Fe2(SO4)3 NaNO3 | |
| B. | (NH4)2SO4 CuSO4 Na2CO3 FeCl3 | |
| C. | Cu(NO3)2 NH4 NO3 FeCl3 H2S | |
| D. | Ba Cl2 Cu(NO3)2 (NH4)2SO4 Fe (NO3)3 |
2.若某地每升海水中含钠元素11.5g,则该海水中氯化钠(设钠都以氯化钠的形式存在)的含量为( )
| A. | 23g/L | B. | 27.2g/L | C. | 29.25g/L | D. | 32.4g/L |
10.在某温度时,水的离子积为1×10-12 mol2•L-2,若该温度下某溶液中H+浓度为1×10-7 mol•L-1,则该溶液( )①呈碱性 ②呈酸性 ③[H+]=100[OH-]④[OH-]=100[H+]⑤呈中性.
| A. | ①④ | B. | ② | C. | ②③ | D. | ⑤ |
7.表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
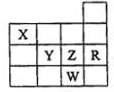

| A. | 常压下五种元素的单质中W单质的沸点最高 | |
| B. | Y、Z和W的阴离子半径依次增大 | |
| C. | X的氢化物比同族元素的氢化物还原性强 | |
| D. | Z元素的最高价氧化物的水化物酸性最强 |
8.下列物质的水溶液中存在溶质分子的是( )
| A. | HCl | B. | NaHCO3 | C. | 蔗糖 | D. | Na2CO3 |
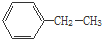 乙苯 ②
乙苯 ②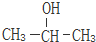 2-丙醇
2-丙醇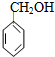 苯甲醇 ④
苯甲醇 ④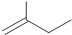 2-甲基-1-丁烯
2-甲基-1-丁烯 ③二乙酸乙二酯
③二乙酸乙二酯 ④甘氨酸H2NCH2COOH.
④甘氨酸H2NCH2COOH.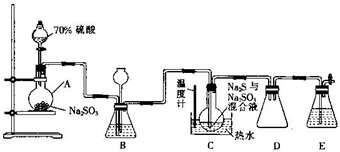 Na2S2O3•5H2O俗称:“海波”,是常用的定影剂和还原剂,它是无色晶体,易溶于水,不溶于乙醇,遇酸易分解:S2O32-+2H+=S↓+SO2↑+H2O,在20℃和70℃时的溶解度分别为60.0g和212.0g,Na2S2O3•5H2O在40~50℃时会熔化,48℃时会分解,工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如图所示的装置(略去部分夹持仪器)模拟生成过程.
Na2S2O3•5H2O俗称:“海波”,是常用的定影剂和还原剂,它是无色晶体,易溶于水,不溶于乙醇,遇酸易分解:S2O32-+2H+=S↓+SO2↑+H2O,在20℃和70℃时的溶解度分别为60.0g和212.0g,Na2S2O3•5H2O在40~50℃时会熔化,48℃时会分解,工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如图所示的装置(略去部分夹持仪器)模拟生成过程.