题目内容
4.右图是部分短周期主族元素原子半径与原子序数的关系图.下列说法错误的是( )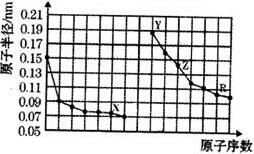
| A. | X、Y两种单质在常温下反应生成的产物为碱性氧化物 | |
| B. | Z2R3可由Y2R和ZCl3的溶液反应制取 | |
| C. | Y、Z、R三种元素对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |
分析 同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,X为O元素,Y为Na元素,Z为Al元素,R为S元素,
A.X、Y两种单质在常温下反应生成的产物为氧化钠,能和酸反应只生成盐和水的氧化物为碱性氧化物;
B.Al2S3可在水溶液中易发生双水解;
C.Y、Z、R三种元素对应的最高价氧化物的水化物分别是NaOH、Al(OH)3、H2SO4,氢氧化铝是两性氢氧化物,能和酸、碱反应生成盐和水;
D.X、Z构成的化合物是氧化铝,工业上用电解熔融氧化铝的方法冶炼铝.
解答 解:同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,X为O元素,Y为Na元素,Z为Al元素,R为S元素,
A.X、Y两种单质在常温下反应生成的产物为氧化钠,能和酸反应只生成盐和水的氧化物为碱性氧化物,氧化钠和酸反应只生成盐和水,则氧化钠是碱性氧化物,故A正确;
B.Al2S3可在水溶液中易发生双水解,所以不能在水溶液中制取硫化铝,故B错误;
C.Y、Z、R三种元素对应的最高价氧化物的水化物分别是NaOH、Al(OH)3、H2SO4,氢氧化铝是两性氢氧化物,能和酸、碱反应生成盐和水,氢氧化钠和稀硫酸发生中和反应,所以Y、Z、R三种元素对应的最高价氧化物的水化物相互之间可以发生反应,故C正确;
D.X、Z构成的化合物是氧化铝,铝是亲氧元素,较活泼,工业上用电解熔融氧化铝的方法冶炼铝,故D正确;
故选B.
点评 本题考查原子结构和元素周期律,为高频考点,明确原子结构、元素周期表结构、物质性质是解本题关键,侧重考查学生分析判断及应用能力,注意规律中的反常现象,易错选项是D.

练习册系列答案
相关题目
16.常温下,向20mL的某稀H2SO4溶液中滴入0.1mol/L氨水,溶液中水电离出氢离子浓度随滴入氨水体积变化如图.下列分析正确的是( )
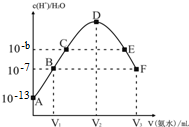

| A. | E溶液中存在:c(NH4+)>c(SO42-)>c(OH-)>c(H+) | |
| B. | 稀硫酸的浓度为0.1mol/L | |
| C. | C点溶液pH=14-b | |
| D. | V2=20 mL |
13.已知C8H11N的同分异构体中含有苯环的有很多种(不考虑立体异构),苯环上有一个侧链,二个侧链和三个侧链的种数分别是( )
| A. | 5 9 6 | B. | 5 6 6 | C. | 3 9 7 | D. | 4 6 7 |
18.a、b、c、d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c.下列叙述错误的是( )
| A. | d元素的非金属性最强 | |
| B. | 它们均存在两种或两种以上的氧化物 | |
| C. | 只有a与题中其他元素生成的化合物都是离子化合物 | |
| D. | c、d形成的气态氢化物的还原性:d>c |
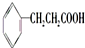
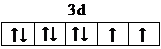 ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③
,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③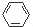 、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
 能源、材料和信息是现代社会的三大“支柱”.
能源、材料和信息是现代社会的三大“支柱”.
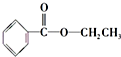 、
、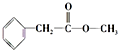 ;
; .
.