题目内容
18.下列关于氯元素的单质及化合物的说法不正确的是( )| A. | 氯元素在自然界中只以化合态形式存在 | |
| B. | H2在Cl2中燃烧会产生苍白色火焰 | |
| C. | 漂粉精是混合物,其有效成分是次氯酸钠 | |
| D. | 久置氯水最终变为稀盐酸 |
分析 A.氯元素是活泼非金属元素,自然界中无游离态;
B.氢气在氯气中燃烧放出苍白色火焰;
C.漂白精是氯化钙和次氯酸钙的混合物,有效成分为次氯酸钙;
D.氯水中氯气和水反应生成盐酸和次氯酸,次氯酸见光分解生成氧气和盐酸,随反应进行最后为稀盐酸;
解答 解:A.氯元素是活泼非金属元素,自然界中无游离态,只以化合态形式存在,故A正确;
B.氢气在氯气中燃烧放出苍白色火焰,生成氯化氢,故B正确;
C.漂白精是氯气和氢氧化钙反生成的氯化钙和次氯酸钙的混合物,有效成分为次氯酸钙,故C错误;
D.氯水中氯气和水反应生成盐酸和次氯酸,次氯酸见光分解生成氧气和盐酸,2HClO$\frac{\underline{\;光\;}}{\;}$2HCl+O2↑,促进平衡正向进行,随反应进行最后为稀盐酸,故D正确;
故选C.
点评 本题考查了氯及其化合物性质和制备,主要是氯水成分判断,漂白精的制备原理,掌握基础是解题关键,题目较简单.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
8.在3H2S+H2SO4═4S↓+4H2O 中,氧化产物与还原产物的物质的量之比为( )
| A. | 1:1 | B. | 3:1 | C. | 1:3 | D. | 1:4 |
9.浓度为0.05mol•L-1的Na2SO3溶液24mL恰好能被20mL浓度为0.02mol•L-1的K2Cr2O7溶液氧化为Na2SO4,则K2Cr2O7被还原后得到的产物中Cr元素的化合价为( )
| A. | +5 | B. | +4 | C. | +3 | D. | +2 |
6.下列离子反应方程式正确的是( )
| A. | 将少量SO2气体通入NaClO溶液中:2ClO-+SO2+H2O→SO32-+2HClO | |
| B. | 硫化氢气体通入硫酸亚铁溶液产生黑色硫化亚铁沉淀:H2S+Fe2+→FeS↓+2H+ | |
| C. | 向偏铝酸钠溶液中通入过量CO2:AlO2-+CO2+2H2O→Al(OH)3↓+HCO3- | |
| D. | 向硫酸铝铵[NH4Al(SO4)2]溶液中滴加足量Ba(OH)2溶液NH4++Al3++2SO42-+2Ba2++5OH-→AlO2-+2BaSO4↓+NH3•H2O+2H2O |
3.对于反应2SO2(气)+O2(气)$?_{△}^{催化剂}$2SO3(气),下列判断正确的是( )
| A. | 2mol SO2和足量的O2反应,必定生成2mol SO3 | |
| B. | 当v(正)>V(逆)时,随着反应的进行,反应物的物质的量逐渐减小 | |
| C. | 正反应速率之比为v(SO2):v(O2):v(SO3)=2:1:2时,反应达到平衡 | |
| D. | 反应达到平衡后,升高温度,平衡不一定发生移动 |
1.已知在常温下测得浓度均为0.1mol•L-1的下列四种溶液的pH如下表:
(1)用离子方程式表示NaClO溶液的pH=9.7的原因ClO-+H2O?HClO+OH-.
(2)根据盐溶液的pH,可知①Ka(HClO) ②Ka1(H2CO3) ③Ka(HF) ④Ka2(H2CO3)的大小顺序为③②①④.
(3)将少量CO2通入NaClO溶液中,写出该反应的离子方程式:CO2+H2O+ClO-=HClO+HCO3-.
(4)将CO2通入0.1mol•L-1的Na2CO3溶液中至中性,则溶液中2c(CO32-)+c(HCO3-)=0.2mol•L-1.
| 溶质 | NaHCO3 | Na2CO3 | NaF | NaClO |
| pH | 8.4 | 11.6 | 7.5 | 9.7 |
(2)根据盐溶液的pH,可知①Ka(HClO) ②Ka1(H2CO3) ③Ka(HF) ④Ka2(H2CO3)的大小顺序为③②①④.
(3)将少量CO2通入NaClO溶液中,写出该反应的离子方程式:CO2+H2O+ClO-=HClO+HCO3-.
(4)将CO2通入0.1mol•L-1的Na2CO3溶液中至中性,则溶液中2c(CO32-)+c(HCO3-)=0.2mol•L-1.
 .
. ,
,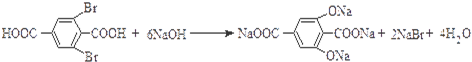 .
.