题目内容
17.恒温、恒压下,1mol A和1mol B在一个容积可变的容器中发生如下反应:A(g)+2B(g)?2C(g),一段时间后达到平衡,生成a mol C,则下列说法中正确的是( )| A. | 物质A、B的转化率之比为1:2 | |
| B. | 起始时刻和达平衡后容器中混合气体密度相等 | |
| C. | 当v正(A)=2v逆(C)时,可断定反应达到平衡状态 | |
| D. | 若起始时放入3 mol A和3 mol B,则达平衡时生成 3a mol C |
分析 A.A、B的起始量都是1mol,所以A、B的转化率之比等于参加反应的物质的物质的量之比;
B.起始时刻和达平衡后容器体积不等,则密度不等;
C.反应达平衡时,正逆反应速率相等,根据速率之比等于化学计量数之比判断;
D.在恒压下,放入3molA和3nmolB,与起始时1molA和nmolB配比数相等,为等效平衡.
解答 解:A.A、B的起始量都是1mol,所以A、B的转化率之比等于参加反应的物质的物质的量之比,根据反应方程式可知,物质A、B的转化率之比一定是1:2,故A正确;
B.在恒压下,随着反应的进行,气体的物质的量逐渐减小,则容器的体积逐渐减小,起始时刻和达平衡后容器体积不等,则密度不等,故B错误;
C.当2v正(A)=v逆(C)时,正逆反应速率相等,反应达到平衡状态,故C错误;
D.在恒压下,放入3molA和3nmolB,与起始时1molA和nmolB配比数相等,为等效平衡,则达平衡时生成3amolC,故D正确.
故选AD.
点评 本题综合考查化学平衡问题,为高考常见题型和高频考点,侧重考查平衡标志的判断,转化率、及等效平衡问题,题目难度不大,注意反应在恒压条件下进行的状态.

练习册系列答案
相关题目
4.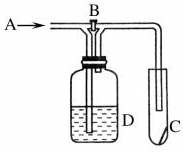 如图是一种试验某气体化学性质的实验装置,图中B为开关.若先打开B,在A处通入干燥的氯气,C中红色布条颜色无变化;当关闭B在A处通入干燥的氯气时,C中红色布条颜色褪去.则D瓶中盛有的溶液是( )
如图是一种试验某气体化学性质的实验装置,图中B为开关.若先打开B,在A处通入干燥的氯气,C中红色布条颜色无变化;当关闭B在A处通入干燥的氯气时,C中红色布条颜色褪去.则D瓶中盛有的溶液是( )
 如图是一种试验某气体化学性质的实验装置,图中B为开关.若先打开B,在A处通入干燥的氯气,C中红色布条颜色无变化;当关闭B在A处通入干燥的氯气时,C中红色布条颜色褪去.则D瓶中盛有的溶液是( )
如图是一种试验某气体化学性质的实验装置,图中B为开关.若先打开B,在A处通入干燥的氯气,C中红色布条颜色无变化;当关闭B在A处通入干燥的氯气时,C中红色布条颜色褪去.则D瓶中盛有的溶液是( )| A. | 浓NaI溶液 | B. | 浓NaOH溶液 | C. | 饱和NaCl溶液 | D. | 浓硫酸 |
8.某化学小组以苯甲酸( )为原料,制取苯甲酸甲酯.已知有关物质的沸点如表:
)为原料,制取苯甲酸甲酯.已知有关物质的沸点如表:
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g苯甲酸(M=122g/mol)和20ml甲醇(密度约0.79g•mL-1 ),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品.
(1)若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式C6H5CO18OH+CH3OH $\frac{\underline{\;浓硫酸\;}}{△}$C6H5COOCH3+H218O;浓硫酸的作用是:催化剂、吸水剂.
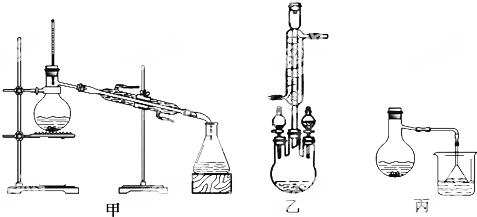
(2)甲、乙、丙三位同学分别设计了如图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).根据有机物的沸点,最好采用乙装置(填“甲”或“乙”或“丙”).
Ⅱ.粗产品的精制
(3)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制,请根据流程图写出操作方法的名称.操作Ⅰ分液 操作Ⅱ蒸馏.

(4)能否用NaOH溶液代替饱和碳酸钠溶液?否(填“能”或“否”),并简述原因氢氧化钠是强碱,促进苯甲酸甲酯的水解,导致产品损失.
(5)通过计算,苯甲酸甲酯的产率是65% .
 )为原料,制取苯甲酸甲酯.已知有关物质的沸点如表:
)为原料,制取苯甲酸甲酯.已知有关物质的沸点如表:| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
在圆底烧瓶中加入12.2g苯甲酸(M=122g/mol)和20ml甲醇(密度约0.79g•mL-1 ),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品.
(1)若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式C6H5CO18OH+CH3OH $\frac{\underline{\;浓硫酸\;}}{△}$C6H5COOCH3+H218O;浓硫酸的作用是:催化剂、吸水剂.
(2)甲、乙、丙三位同学分别设计了如图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).根据有机物的沸点,最好采用乙装置(填“甲”或“乙”或“丙”).

Ⅱ.粗产品的精制
(3)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制,请根据流程图写出操作方法的名称.操作Ⅰ分液 操作Ⅱ蒸馏.

(4)能否用NaOH溶液代替饱和碳酸钠溶液?否(填“能”或“否”),并简述原因氢氧化钠是强碱,促进苯甲酸甲酯的水解,导致产品损失.
(5)通过计算,苯甲酸甲酯的产率是65% .
5.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$.
(2)该反应为吸热反应(选填“吸热”、“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是cd(多选扣分).
a.容器中压强不变
b.c(CO2)=c(CO)
c.υ正(H2)=υ逆(H2O)
d.混合气体中c(CO)不变
(4)830K时,各物质浓度符合下式:c(CO2)•c(H2)=2c(CO)•c(H2O),此时该反应正反应方向进行(填“正反应方向进行”、“逆反应方向进行”或“处于平衡状态”).
| T(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$.
(2)该反应为吸热反应(选填“吸热”、“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是cd(多选扣分).
a.容器中压强不变
b.c(CO2)=c(CO)
c.υ正(H2)=υ逆(H2O)
d.混合气体中c(CO)不变
(4)830K时,各物质浓度符合下式:c(CO2)•c(H2)=2c(CO)•c(H2O),此时该反应正反应方向进行(填“正反应方向进行”、“逆反应方向进行”或“处于平衡状态”).
12.“材料“的发现和使用往往会极大地推动生产、生活的发展,一些材料的出现甚至具有里程碑式划时代的意义.请回答下列问题:
Ⅰ.(1)石棉(CaMg3Si4O12)是常用的耐火材料,用氧化物的形式表示其组成为CaO•3MgO•4SiO2.
(2)高分子材料可以分成无机高分子材料和有机高分子材料.[AlFe(OH)nCl6-n]m属于无机高分子材料,是一种新型高效净水剂,它广泛应用于生活用水和工业污水的处理,其中铁元素的化合价为+3.
Ⅱ.高纯二氧化硅可用来制造光纤.某稻壳灰的成分如下表:
通过如下流程可由稻壳灰制备较纯净的二氧化硅:
请回答下列问题:
(1)根据氧化物的性质进行分类,稻壳灰中涉及的氧化物的种类最多有3类,其中SiO2为酸性氧化物(填氧化物的类别)
(2)滤渣A的成分有C和Fe2O3填化学式)
(3)步骤②洗涤沉淀的方法是向漏斗中加水至浸没沉淀,待水自然流下后,再重复2-3次
(4)步骤③反应的化学方程式为:H2SiO3$\frac{\underline{\;\;△\;\;}}{\;}$SiO2+H2O;实验室进行步骤③用到的仪器有坩埚、泥三角、酒精灯、坩埚钳和三脚架.
Ⅰ.(1)石棉(CaMg3Si4O12)是常用的耐火材料,用氧化物的形式表示其组成为CaO•3MgO•4SiO2.
(2)高分子材料可以分成无机高分子材料和有机高分子材料.[AlFe(OH)nCl6-n]m属于无机高分子材料,是一种新型高效净水剂,它广泛应用于生活用水和工业污水的处理,其中铁元素的化合价为+3.
Ⅱ.高纯二氧化硅可用来制造光纤.某稻壳灰的成分如下表:
| 组分 | SiO2 | C | Na2O | K2O | Al2O3 | Fe2O3 |
| 质量分数/% | 59.20 | 38.80 | 0.25 | 0.50 | 0.64 | 0.61 |

请回答下列问题:
(1)根据氧化物的性质进行分类,稻壳灰中涉及的氧化物的种类最多有3类,其中SiO2为酸性氧化物(填氧化物的类别)
(2)滤渣A的成分有C和Fe2O3填化学式)
(3)步骤②洗涤沉淀的方法是向漏斗中加水至浸没沉淀,待水自然流下后,再重复2-3次
(4)步骤③反应的化学方程式为:H2SiO3$\frac{\underline{\;\;△\;\;}}{\;}$SiO2+H2O;实验室进行步骤③用到的仪器有坩埚、泥三角、酒精灯、坩埚钳和三脚架.
6.下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的物质是( )
①NaHCO3②Al2O3 ③Al(OH)3 ④Al ⑤(NH4)2CO3 ⑥Na[Al(OH)4].
①NaHCO3②Al2O3 ③Al(OH)3 ④Al ⑤(NH4)2CO3 ⑥Na[Al(OH)4].
| A. | ①②③④⑤ | B. | ①②③⑤ | C. | ①②③ | D. | 全部 |
 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.