题目内容
取一份矿石试样进行实验,首先将其溶于过量的盐酸,过滤后,向所得的沉淀X和溶液Y中分别加入NaOH溶液至过量(该矿石可看作由MgO、A12O3、SiO2、Fe2O3等矿物组成).则下列叙述错误的是( )
| A、溶液Y中加入过量的NaOH溶液后过滤,滤液和沉淀中各含两种金属元素 |
| B、该矿石成分中能溶于盐酸的都是碱性氧化物,不溶的是酸性氧化物 |
| C、溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+ |
| D、沉淀X的成分是SiO2 |
考点:硅和二氧化硅,镁、铝的重要化合物,铁的氧化物和氢氧化物
专题:几种重要的金属及其化合物
分析:据金属氧化物MgO、Fe2O3会溶于酸,不会溶于碱,二氧化硅、A12O3、氢氧化铝会溶于强碱进行分析.
A、氯化镁和氯化铁、氯化铝中加入过量氢氧化钠后,会生成沉淀Fe(OH)3和Mg(OH)2,Al(OH)3能溶于强碱,不能溶于弱碱;
B、组成中有氧化铝为两性氧化物、二氧化硅为酸性氧化物;
C、MgO、A12O3、Fe2O3都能与过量盐酸反应生成金属阳离子;
D、二氧化硅不溶于水,也不溶于酸,Fe2O3不溶于水,溶于酸.
A、氯化镁和氯化铁、氯化铝中加入过量氢氧化钠后,会生成沉淀Fe(OH)3和Mg(OH)2,Al(OH)3能溶于强碱,不能溶于弱碱;
B、组成中有氧化铝为两性氧化物、二氧化硅为酸性氧化物;
C、MgO、A12O3、Fe2O3都能与过量盐酸反应生成金属阳离子;
D、二氧化硅不溶于水,也不溶于酸,Fe2O3不溶于水,溶于酸.
解答:
解:金属氧化物MgO、A12O3、Fe2O3会溶于盐酸,生成氯化镁、氯化铝以及氯化铁,过滤后,得的沉淀X是二氧化硅,溶液Y中含有氯化镁、氯化铝以及氯化铁以及过量的盐酸,向Y中加入过量的氢氧化钠,会生成氢氧化镁、氢氧化铁沉淀,过滤后的溶液中含有氯化钠、偏铝酸钠等.
A、溶液Y中加入过量的NaOH溶液后过滤,过滤后的溶液中含有氯化钠、偏铝酸钠,沉淀是氢氧化镁、氢氧化铁沉淀,滤液和沉淀中各含两种金属元素,故A正确;
B、蛇纹石成分中能溶于盐酸的有MgO、A12O3、Fe2O3,MgO、Fe2O3是碱性氧化物,不溶的SiO2是酸性氧化物,A12O3是两性氧化物,故B错误;
C、溶液Y中含有氯化镁、氯化铝以及氯化铁以及过量的盐酸,含有的阳离子主要是Mg2+、Al3+、Fe3+、H+,故C正确;
D、沉淀X的成分是SiO2,故D正确;
故选B.
A、溶液Y中加入过量的NaOH溶液后过滤,过滤后的溶液中含有氯化钠、偏铝酸钠,沉淀是氢氧化镁、氢氧化铁沉淀,滤液和沉淀中各含两种金属元素,故A正确;
B、蛇纹石成分中能溶于盐酸的有MgO、A12O3、Fe2O3,MgO、Fe2O3是碱性氧化物,不溶的SiO2是酸性氧化物,A12O3是两性氧化物,故B错误;
C、溶液Y中含有氯化镁、氯化铝以及氯化铁以及过量的盐酸,含有的阳离子主要是Mg2+、Al3+、Fe3+、H+,故C正确;
D、沉淀X的成分是SiO2,故D正确;
故选B.
点评:本题考查物质的组成和性质,明确组成中物质与酸、与碱发生的化学反应是解答本题的关键,难度不大,关键是理解氧化铝是两性氧化物.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
用NA代表阿伏伽德罗常数的值.下列叙述正确的是( )
| A、1mol乙烷分子中含有8NA个共价键 |
| B、0.05mol熔融的KHSO4中含有阳离子的数目为0.05 NA |
| C、标准状况下,22.4L甲醇的分子数为NA |
| D、1mol/L的氯化铵溶液含氮原子数为 NA |
下列是有关实验操作的步骤和做法,不正确的是( )
| A、粗盐提纯操作的顺序是:溶解、过滤、蒸发、洗涤 |
| B、实验室制取氧气完毕后,应先取出集气瓶,再取出导管,最后停止加热 |
| C、不慎将浓硫酸洒在桌上,应先用烧碱溶液中和,再用湿布抹净 |
| D、用试管夹夹持试管时,把试管夹从试管底部往上套,夹在试管中上部 |

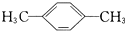 的系统命名为
的系统命名为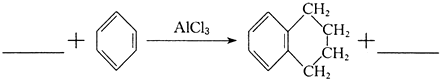

 某同学设计实验探究构成原电池的条件,装置如下:
某同学设计实验探究构成原电池的条件,装置如下: