题目内容
已知B是合成聚对苯二甲酸乙二醇酯(PET)的重要原料,有如下转化关系CH2═CH2
A→B
C.
(1)B的官能团名称为 .
(2)A→B的反应方程式是 ,反应类型
(3)向盛有1mL银氨溶液的洁净试管中滴入适量C,振荡后水浴加热可观察到的现象是 ,反应方程式为 .
(4)工业合成PET过程如下:

①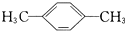 的系统命名为 ,步骤Ⅲ的反应方程式为 ;
的系统命名为 ,步骤Ⅲ的反应方程式为 ;
②用步骤Ⅰ得到的信息完善下列方程式:
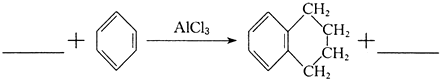
③实验室完成转化Ⅱ所需试剂为 .
| Br2 |
| Cu/O2 |
| △ |
(1)B的官能团名称为
(2)A→B的反应方程式是
(3)向盛有1mL银氨溶液的洁净试管中滴入适量C,振荡后水浴加热可观察到的现象是
(4)工业合成PET过程如下:

①
 的系统命名为
的系统命名为②用步骤Ⅰ得到的信息完善下列方程式:

③实验室完成转化Ⅱ所需试剂为
考点:有机物的推断,有机物的合成
专题:
分析:乙烯与溴发生加成反应生成A为BrCH2CH2Br,A在氢氧化钠水溶液、加热条件下发生水解反应生成B为HOCH2CH2OH,B发生催化氧化生成C为OHC-CHO.
(4)甲苯与CH3Cl发生取代反应生成 ,对二甲苯被酸性高锰酸钾溶液氧化生成X为
,对二甲苯被酸性高锰酸钾溶液氧化生成X为 ,对苯二甲酸与乙二醇发生缩聚反应生成聚对苯二甲酸乙二醇酯.
,对苯二甲酸与乙二醇发生缩聚反应生成聚对苯二甲酸乙二醇酯.
(4)甲苯与CH3Cl发生取代反应生成
 ,对二甲苯被酸性高锰酸钾溶液氧化生成X为
,对二甲苯被酸性高锰酸钾溶液氧化生成X为 ,对苯二甲酸与乙二醇发生缩聚反应生成聚对苯二甲酸乙二醇酯.
,对苯二甲酸与乙二醇发生缩聚反应生成聚对苯二甲酸乙二醇酯.解答:
解:乙烯与溴发生加成反应生成A为BrCH2CH2Br,A在氢氧化钠水溶液、加热条件下发生水解反应生成B为HOCH2CH2OH,B发生催化氧化生成C为OHC-CHO,
(1)B为HOCH2CH2OH,含有官能团为羟基,故答案为:羟基;
(2)A→B的反应方程式是:BrCH2CH2Br+NaOH
HOCH2CH2OH+2NaBr,属于取代反应,
故答案为:BrCH2CH2Br+NaOH
HOCH2CH2OH+2NaBr,取代反应;
(3)向盛有1mL银氨溶液的洁净试管中滴入适量OHC-CHO,振荡后水浴加热可观察到的现象是:有银镜产生,反应方程式为:OHC-CHO+4Ag(NH3)2OH
NH4OOCCOONH4+4Ag↓+6NH3+2H2O,
故答案为:有银镜产生;OHC-CHO+4Ag(NH3)2OH
NH4OOCCOONH4+4Ag↓+6NH3+2H2O;
(4)甲苯与CH3Cl发生取代反应生成 ,对二甲苯被酸性高锰酸钾溶液氧化生成X为
,对二甲苯被酸性高锰酸钾溶液氧化生成X为 ,对苯二甲酸与乙二醇发生缩聚反应生成聚对苯二甲酸乙二醇酯,
,对苯二甲酸与乙二醇发生缩聚反应生成聚对苯二甲酸乙二醇酯,
① 的系统命名为1,3-二甲苯,步骤Ⅲ的反应方程式为
的系统命名为1,3-二甲苯,步骤Ⅲ的反应方程式为 ,
,
故答案为:1,3-二甲苯; ;
;
②根据步骤Ⅰ可知,该反应反应生成:苯与ClCH2CH2CH2CH2Cl,发生取代反应,反应方程式为: +ClCH2CH2CH2CH2Cl
+ClCH2CH2CH2CH2Cl
 +2HCl,
+2HCl,
故答案为:ClCH2CH2CH2CH2Cl;2HCl;
③转化Ⅱ是将对二甲苯氧化生成对苯二甲酸,实验室完成转化Ⅱ所需试剂为:酸性高锰酸钾溶液,故答案为:酸性高锰酸钾溶液.
(1)B为HOCH2CH2OH,含有官能团为羟基,故答案为:羟基;
(2)A→B的反应方程式是:BrCH2CH2Br+NaOH
| 水 |
| △ |
故答案为:BrCH2CH2Br+NaOH
| 水 |
| △ |
(3)向盛有1mL银氨溶液的洁净试管中滴入适量OHC-CHO,振荡后水浴加热可观察到的现象是:有银镜产生,反应方程式为:OHC-CHO+4Ag(NH3)2OH
| △ |
故答案为:有银镜产生;OHC-CHO+4Ag(NH3)2OH
| △ |
(4)甲苯与CH3Cl发生取代反应生成
 ,对二甲苯被酸性高锰酸钾溶液氧化生成X为
,对二甲苯被酸性高锰酸钾溶液氧化生成X为 ,对苯二甲酸与乙二醇发生缩聚反应生成聚对苯二甲酸乙二醇酯,
,对苯二甲酸与乙二醇发生缩聚反应生成聚对苯二甲酸乙二醇酯,①
 的系统命名为1,3-二甲苯,步骤Ⅲ的反应方程式为
的系统命名为1,3-二甲苯,步骤Ⅲ的反应方程式为 ,
,故答案为:1,3-二甲苯;
 ;
;②根据步骤Ⅰ可知,该反应反应生成:苯与ClCH2CH2CH2CH2Cl,发生取代反应,反应方程式为:
 +ClCH2CH2CH2CH2Cl
+ClCH2CH2CH2CH2Cl| AlCl3 |
 +2HCl,
+2HCl,故答案为:ClCH2CH2CH2CH2Cl;2HCl;
③转化Ⅱ是将对二甲苯氧化生成对苯二甲酸,实验室完成转化Ⅱ所需试剂为:酸性高锰酸钾溶液,故答案为:酸性高锰酸钾溶液.
点评:本题考查有机物推断与合成,是对有机化学基础的综合考查,需要学生熟练掌握官能团的性质与转化,难度中等.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、硫酸铝溶液中滴加过量浓氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、乙酸钠溶液显碱性原因:CH3COO-+H2O=CH3COOH+OH- |
| C、氢氧化钠溶液吸收少量SO2气体:SO2+2OH-=SO32-+H2O |
| D、漂白粉放置在空气中变质:ClO-+CO2+H2O=HClO+HCO3- |
取一份矿石试样进行实验,首先将其溶于过量的盐酸,过滤后,向所得的沉淀X和溶液Y中分别加入NaOH溶液至过量(该矿石可看作由MgO、A12O3、SiO2、Fe2O3等矿物组成).则下列叙述错误的是( )
| A、溶液Y中加入过量的NaOH溶液后过滤,滤液和沉淀中各含两种金属元素 |
| B、该矿石成分中能溶于盐酸的都是碱性氧化物,不溶的是酸性氧化物 |
| C、溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+ |
| D、沉淀X的成分是SiO2 |
有关物质与反应分类的下列说法中,正确的是( )
| A、硅酸钠是钠盐,也是硅酸盐 |
| B、碳酸钠使无色酚酞试液变红,属于碱 |
| C、CO2溶于水能导电,属电解质 |
| D、CO还原氧化铁获得铁,属于置换反应 |


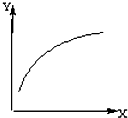 在密闭容器中加入A、B两种物质,在一定条件下反应:2A(s)+B(g)?2C(g) (△H<0).达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
在密闭容器中加入A、B两种物质,在一定条件下反应:2A(s)+B(g)?2C(g) (△H<0).达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )