题目内容
A为两种金属组成的合金,发生如图所示的变化:
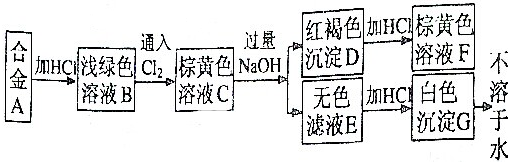
(1)合金A由 和 组成;
(2)写出下列变化的离子方程式:
C→E ;
D→F .

(1)合金A由
(2)写出下列变化的离子方程式:
C→E
D→F
考点:生活中常见合金的组成
专题:元素及其化合物
分析:含Fe2+溶液是浅绿色的,能被氯气氧化为Fe3+,Al可以和盐酸反应得到可溶性的含有Al3+的盐,铝离子和过量的NaOH反应会生成偏铝酸钠的水溶液,向其中加盐酸会出现氢氧化铝沉淀,据此确定各个物质来回答判断.
解答:
解:含Fe2+溶液是浅绿色的,能被氯气氧化为Fe3+,Al可以和盐酸反应得到可溶性的含有Al3+的盐,铝离子和过量的NaOH反应会生成偏铝酸钠的水溶液,向其中加盐酸会出现氢氧化铝沉淀,
所以合金是金属铁和铝的合金,B是氯化亚铁溶液,C是氯化铁溶液,D是氢氧化铁沉淀,E是偏铝酸钠溶液,G是氢氧化铝.
(1)合金是金属铁和铝的合金,故答案为:Fe;Al;
(2)氯化铝和过量的氢氧化钠反应的离子方程式为:Al3++4OH-═AlO2-+2H2O,氢氧化铁溶于盐酸的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O,
故答案为:Al3++4OH-═AlO2-+2H2O,Fe(OH)3+3H+=Fe3++3H2O.
所以合金是金属铁和铝的合金,B是氯化亚铁溶液,C是氯化铁溶液,D是氢氧化铁沉淀,E是偏铝酸钠溶液,G是氢氧化铝.
(1)合金是金属铁和铝的合金,故答案为:Fe;Al;
(2)氯化铝和过量的氢氧化钠反应的离子方程式为:Al3++4OH-═AlO2-+2H2O,氢氧化铁溶于盐酸的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O,
故答案为:Al3++4OH-═AlO2-+2H2O,Fe(OH)3+3H+=Fe3++3H2O.
点评:本题考查了离子方程式正误判断,明确物质之间的反应及离子方程式书写规则即可解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列关于漂白粉的叙述正确的是( )
| A、漂白粉的有效成分是Ca(ClO)2和CaCl2 |
| B、漂白粉在空气中久置后会变质 |
| C、漂白粉的有效成分CaCl2 |
| D、漂白粉的主要成分是CaCl2 |
 利用如图所示装置收集以下8种气体(图中试管的位置不得变化):
利用如图所示装置收集以下8种气体(图中试管的位置不得变化): 现需配制0.1mol/LNaOH溶液480mL,如图是某同学转移溶液的示意图.
现需配制0.1mol/LNaOH溶液480mL,如图是某同学转移溶液的示意图. 已知:N2O4(g)=2NO2(g);△H=+57.20kJ?mol-1.
已知:N2O4(g)=2NO2(g);△H=+57.20kJ?mol-1. 图为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线.试回答:
图为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线.试回答: