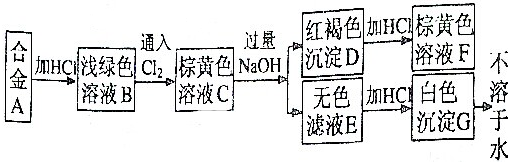
题目内容
 已知:N2O4(g)=2NO2(g);△H=+57.20kJ?mol-1.
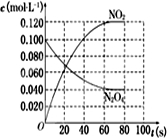
已知:N2O4(g)=2NO2(g);△H=+57.20kJ?mol-1.在100℃时,将0.100mol的四氧化二氮气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内的物质浓度进行分析得到下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol/L | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol/L | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
(2)在图中画出并标明此反应中N2O4和NO2的浓度随时间变化的曲线.
(3)在上述条件下,从反应开始至达到化学平衡时,四氧化二氮的平均反应速率为
(4)若起始时充入NO2气体0.200mol,则达到平衡时NO2气体的转化率为
其他条件不变时,下列措施能提高NO2转化率的是
A.减小NO2的浓度
B.降低温度
C.增加NO2的浓度
D.升高温度
E.再充入一定量的He.
考点:化学平衡的计算,化学平衡的影响因素
专题:
分析:(1)平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,根据方程式计算c2、c1,据此解答;60s后反应达平衡,反应混合物各组分的浓度不变;
(2)依据起始浓度,平衡浓度和图表中的浓度,描点画出变化图象;
(3)由表可知,60s时反应达平衡,根据方程式计算△c(N2O4),依据化学反应速率V=
计算得到;
(4)依据平衡浓度计算平衡常数,结合化学平衡三段式列式计算,转化率=
×100%,依据化学平衡原理分析改变条件提高NO2转化率的选项.
(2)依据起始浓度,平衡浓度和图表中的浓度,描点画出变化图象;
(3)由表可知,60s时反应达平衡,根据方程式计算△c(N2O4),依据化学反应速率V=
| △c |
| △t |
(4)依据平衡浓度计算平衡常数,结合化学平衡三段式列式计算,转化率=
| 消耗量 |
| 起始量 |
解答:
解:(1)N2O4(g)?2NO2(g),反应的平衡常数K=
;
20s时c(NO2)=0.060mol/L
N2O4?2 NO2,
浓度变化 0.030mol 0.060mol/L
c1=0.10mol/L-0.03mol/L=0.070mol/L;
由表可知,40s时,c(N2O4)=0.050mol/L,
N2O4?2 NO2,
浓度变化:(0.1-0.05)mol/L 0.10mol/L
所以c2=0.10mol/L
由表可知,60s时,c(NO2)=0.120mol/L
N2O4?2 NO2,
浓度变化 0.010mol 0.020mol/L
c3=0.05mol/L-0.01mol/L=0.04mol/L;
由表可知,80s时,c(NO2)=0.120mol/L
c4=0.04mol/L;
所以c2>c1;c3=c4
故答案为:
;<;=;
(2)依据图表中物质的浓度在坐标系中描点画出变化图象,平衡状态(NO2)=0.120mol/L,c(N2O4)=0.10mol/L-0.060mol/L=0.04mol/L,得到的图象为:
 ,答:
,答: ;
;
(3)由表可知,60s时反应达平衡,c(NO2)=0.120mol/L,
N2O4?2 NO2,
浓度变化:0.06mol/L 0.120mol/L
V(N2O4)=
=0.001mol/(L?s);
故答案为:0.001mol/(L?s);
(4)依据平衡浓度计算平衡常数,
N2O4?2 NO2,
起始量(mol/L) 0.10 0
变化量(mol/L) 0.06 0.12
平衡量(mol/L) 0.04 0.12
K=
=0.36
若起始时充入N02气体0.200mol,设消耗二氧化氮物质的量浓度为x,2 NO2=N2O4 ,K=
2 NO2=N2O4
起始量(mol/L) 0.200 0
变化量(mol/L) x 0.5x
平衡量(mol/L) 0.200-x 0.5x
K=
=
x=0.08mol/L
则达到平衡时N02气体的转化率=
×100%=40%
2 NO2=N2O4 反应是气体体积减小的放热反应,依据化学平衡原理分析选项,增大二氧化氮转化率的条件;
A.减小NO2的浓度,平衡逆向进行,二氧化氮转化率减小,故A不符合;
B.降低温度,平衡正向进行,二氧化氮转化率增大,故B符合;
C.增加NO2的浓度,恒容容器中相当于增大压强,平衡正向进行,二氧化氮转化率增大,故C符合;
D.升高温度,平衡逆向进行,二氧化氮转化率减小,故D不符合;
E.再充入一定量的He,总爱增大,气体分压不变,平衡不变,二氧化氮转化率不变,故E不符合;
故答案为:40%;BC.
| c 2(NO 2) |
| c(N 2O 4) |
20s时c(NO2)=0.060mol/L
N2O4?2 NO2,
浓度变化 0.030mol 0.060mol/L
c1=0.10mol/L-0.03mol/L=0.070mol/L;
由表可知,40s时,c(N2O4)=0.050mol/L,
N2O4?2 NO2,
浓度变化:(0.1-0.05)mol/L 0.10mol/L
所以c2=0.10mol/L
由表可知,60s时,c(NO2)=0.120mol/L
N2O4?2 NO2,
浓度变化 0.010mol 0.020mol/L
c3=0.05mol/L-0.01mol/L=0.04mol/L;
由表可知,80s时,c(NO2)=0.120mol/L
c4=0.04mol/L;
所以c2>c1;c3=c4
故答案为:
| c 2(NO 2) |
| c(N 2O 4) |
(2)依据图表中物质的浓度在坐标系中描点画出变化图象,平衡状态(NO2)=0.120mol/L,c(N2O4)=0.10mol/L-0.060mol/L=0.04mol/L,得到的图象为:
 ,答:
,答: ;
;(3)由表可知,60s时反应达平衡,c(NO2)=0.120mol/L,
N2O4?2 NO2,
浓度变化:0.06mol/L 0.120mol/L
V(N2O4)=
| 0.060mol/L |
| 60s |
故答案为:0.001mol/(L?s);
(4)依据平衡浓度计算平衡常数,
N2O4?2 NO2,
起始量(mol/L) 0.10 0
变化量(mol/L) 0.06 0.12
平衡量(mol/L) 0.04 0.12
K=
| 0.122 |
| 0.04 |
若起始时充入N02气体0.200mol,设消耗二氧化氮物质的量浓度为x,2 NO2=N2O4 ,K=
| 1 |
| 0.36 |
2 NO2=N2O4
起始量(mol/L) 0.200 0
变化量(mol/L) x 0.5x
平衡量(mol/L) 0.200-x 0.5x
K=
| 5x |
| (0.200-x) 2 |
| 1 |
| 0.36 |
则达到平衡时N02气体的转化率=
| 0.08mol/L |
| 0.20mol/L |
2 NO2=N2O4 反应是气体体积减小的放热反应,依据化学平衡原理分析选项,增大二氧化氮转化率的条件;
A.减小NO2的浓度,平衡逆向进行,二氧化氮转化率减小,故A不符合;
B.降低温度,平衡正向进行,二氧化氮转化率增大,故B符合;
C.增加NO2的浓度,恒容容器中相当于增大压强,平衡正向进行,二氧化氮转化率增大,故C符合;
D.升高温度,平衡逆向进行,二氧化氮转化率减小,故D不符合;
E.再充入一定量的He,总爱增大,气体分压不变,平衡不变,二氧化氮转化率不变,故E不符合;
故答案为:40%;BC.
点评:本题考查化学平衡的有关计算、化学平衡的影响因素与平衡图象分析,题目综合性较大,注意基础知识的积累掌握.

练习册系列答案
 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
下列说法正确的是( )
| A、聚酯纤维、有机玻璃、碳纤维都属于有机高分子材料 |
| B、蛋白质的水解产物都含有羧基和羟基 |
| C、曾在茂名轰动一时的PX(即对二甲苯)属于芳香烃,但不属于苯的同系物 |
| D、我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 |