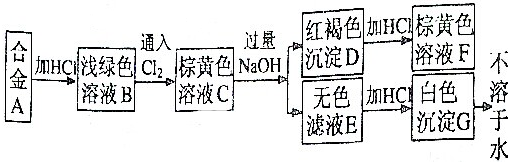
题目内容
用戳有很多小孔的铝箔包好一小块钠放入盛有水的水槽中,用排水法收集得标况下的氢气1.344L,再向水槽内的无色透明溶液逐滴加入0.5mol/L AlCl3溶液,至20mL时开始出现沉淀,当加入40mL时析出沉淀达最大值,求钠块质量和最多析出沉淀的物质的量.
考点:铝的化学性质,化学方程式的有关计算,钠的化学性质
专题:计算题
分析:金属钠和水之间反应也会产生氢气和氢氧化钠2Na+2H2O=2NaOH+H2↑,金属铝可以和氢氧化钠反应产生氢气2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
,根据化学方程式进行计算.
,根据化学方程式进行计算.
解答:
解:设金属钠和铝的物质的量分别是x、y,则
2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
x x 0.5x y y 1.5y
排水法收集得标况下的氢气1.344L即0.06mol,0.06 mol=0.5x+1.5y①;
Na产生的NaOH的量=溶Al耗+溶AlCl3耗x=y+0.5mol/L×0.02L×4,即x=y+0.04②
解得x=0.06mol,y=0.02mol,钠块质量为0.06mol×23g/mol=1.38g;
最大沉淀由Al元素守恒:n(Al(OH)3)=0.02mol+0.5mol/L×40mL=0.04mol,质量是0.04mol×78g/mol=3.12g,
答:钠块质量和最多析出沉淀的物质的量分别是1.38g、3.12g.
2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
x x 0.5x y y 1.5y
排水法收集得标况下的氢气1.344L即0.06mol,0.06 mol=0.5x+1.5y①;
Na产生的NaOH的量=溶Al耗+溶AlCl3耗x=y+0.5mol/L×0.02L×4,即x=y+0.04②
解得x=0.06mol,y=0.02mol,钠块质量为0.06mol×23g/mol=1.38g;
最大沉淀由Al元素守恒:n(Al(OH)3)=0.02mol+0.5mol/L×40mL=0.04mol,质量是0.04mol×78g/mol=3.12g,
答:钠块质量和最多析出沉淀的物质的量分别是1.38g、3.12g.
点评:本题考查学生金属钠和金属铝的化学性质,根据化学方程式的计算是重点,难度中等.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
下列物质的检验,其结论一定正确的是( )
| A、某溶液中加入BaCl2溶液,产生白色沉淀,加入HNO3后,白色沉淀不溶解,也无其他现象,说明该溶液中一定含有SO42- |
| B、某溶液中加盐酸产生刺激性气味的无色气体,该气体能使品红溶液褪色,说明该溶液中一定含有SO32- |
| C、某溶液中加盐酸产生无色气体,该气体能使澄清的石灰水变浑浊,说明该溶液中一定含有CO32- |
| D、取少量久置的Na2SO3样品于试管中加水溶解,再加入足量盐酸有气体产生,然后再加入BaCl2溶液有白色沉淀产生,说明Na2SO3样品已部分被氧化 |
下列各组离子能够大量共存的是( )
| A、pH=0的溶液中:Fe3+、Mg2+、Cl-、SO42- |
| B、能与铝反应生成氢气的溶液中:K+、HC03-、Cl-、S2- |
| C、使pH试纸显蓝色的溶液中:Cu2+、Fe3+、N03-、SO42- |
| D、在A1C13溶液中:Na+、[Al(OH)4]-、SO42-、N03- |