题目内容
14.25℃、1.01×105 Pa时,反应2N2O5(g)═4NO2(g)+O2(g)△H=56.7kJ•mol-1自发进行的原因是( )| A. | 是吸热反应 | B. | 是放热反应 | ||
| C. | 是熵减小的反应 | D. | 熵增大效应大于能量效应 |
分析 反应能否自发进行取决于焓变和熵变的综合判据:△H-T•△S<0,据此解答.
解答 解:反应2N2O5(g)═4NO2(g)+O2(g)△H=+56.7kJ/mol是熵增加的,吸热的反应,根据△G=△H-T•△S判断,反应能自发进行,必须满足△H-T•△S<0才可,即熵增大效应大于能量效应,
故选:D.
点评 本题考查了反应能够自发进行的判断依据,解题时注意反应能否自发进行,不取决于焓变或熵变中的一种,而是二者的综合判据,当△H-T•△S<0时,反应才能自发进行,题目难度不大.

练习册系列答案
相关题目
9.把3mol P和2.5mol Q置于2L密闭容器中,发生如下反应:3P(g)+Q(g)?xM(g)+2N(g),5min后达到平衡生成1mol N,经测定这5min内 M的平均速率是0.1mol/(L•min),下列叙述错误的是( )
| A. | 5min内P的平均反应速率为0.15mol/(L•min) | |
| B. | Q的平衡浓度为1mol/L | |
| C. | Q的转化率为25% | |
| D. | x是2 |
1.下列关系不正确的是( )
| A. | 离子半径:Cl->F->Na+>Al3+ | B. | 原子半径:Na>P>O>F | ||
| C. | 热稳定性:PH3>H2S>HCl>HF | D. | 金属性:Rb>K>Mg>Al |
 Cu3N的晶胞结构如图,N3-的配位数为6,Cu+半径为acm,N3-半径为bcm,Cu3N的密度为$\frac{103}{4{N}_{A}(a+b)^{3}}$g•cm-3.(阿伏加德罗常数用NA表示,Cu、N相对分子质量为64、14)
Cu3N的晶胞结构如图,N3-的配位数为6,Cu+半径为acm,N3-半径为bcm,Cu3N的密度为$\frac{103}{4{N}_{A}(a+b)^{3}}$g•cm-3.(阿伏加德罗常数用NA表示,Cu、N相对分子质量为64、14)
 ;A、B、D的熔点依次增大的顺序为SiO2>NaF>P4.
;A、B、D的熔点依次增大的顺序为SiO2>NaF>P4.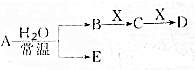 已知A、B、C、D、E、X的转化关系如图所示:
已知A、B、C、D、E、X的转化关系如图所示: