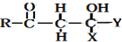题目内容
2.现有某地含硫酸的酸雨水样1m3,其中C(H+)=0.005mol/L,若用生石灰处理该水样至中性,理论上需生石灰多少千克?分析 根据反应方程式列出氧化钙与氢离子的物质的量之间的关系,然后根据关系求解,由此分析解答.
解答 解:CaO~~~H2SO4~~~~2H+
0.056kg 2mol
m(CaO) 0.005mol/L×1×103L
所以$\frac{0.056kg}{m(CaO)}=\frac{2mol}{0.005mol/L×1×1{0}^{3}L}$;解得 m(CaO)=0.14kg,答:论上需生石灰的质量为0.14kg.
点评 本题考查根据反应方程式的相关计算,学生只要知道反应的原理就可以迅速解题,比较简单.

练习册系列答案
相关题目
12.四种短周期元素A、B、C、D的原子序数依次增大,其中A与C,B与D同主族.常温下A的单质是密度最小的气体;B的最高正价与最低负价的代数和为0.下列判断正确的是( )
| A. | A、C两种元素组成的化合物CA为共价化合物 | |
| B. | B元素可形成多种同素异形体 | |
| C. | C元素存在多种核素 | |
| D. | D的氧化物是两性氧化物 |
13.选用如图所示仪器中的两个或几个(内含物质)组装成实验装置,以验证木炭可被浓硫酸氧化成CO2,下列说法正确的是( )
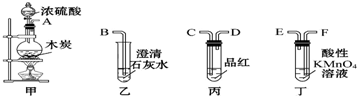

| A. | 按气流从左向右流向,连接装置的正确顺序是A→C→D→F→E→B | |
| B. | 丁中溶液褪色,乙中溶液变浑浊说明甲中生成CO2 | |
| C. | 丙中品红溶液不褪色,乙中溶液变浑浊说明甲中生成CO2 | |
| D. | 丁和丙中溶液都褪色,乙中溶液变浑浊,说明甲中有CO2生成 |
10.下列各组物质中,互称为同分异构体的是( )
| A. | 水与冰 | B. | O2与O3 | C. | 石墨与金刚石 | D. |  与 与  |
17.下列反应过程,同时有离子键、共价键的断裂和形成的反应是( )
| A. | NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+HCl↑ | B. | NH3+CO2+H2O═NH4HCO3 | ||
| C. | Mg+Cl2$\frac{\underline{\;点燃\;}}{\;}$MgCl2 | D. | 2Na2O2+2CO2═2Na2CO3+O2 |
14.25℃、1.01×105 Pa时,反应2N2O5(g)═4NO2(g)+O2(g)△H=56.7kJ•mol-1自发进行的原因是( )
| A. | 是吸热反应 | B. | 是放热反应 | ||
| C. | 是熵减小的反应 | D. | 熵增大效应大于能量效应 |
11.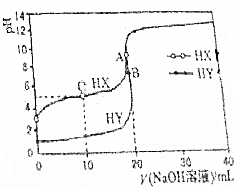 25℃时,用浓度为0.1000mol•L-1的NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的盐酸和醋酸溶液的滴定曲线如图所示(混合溶液体积变化忽略不计).下列说法不正确的是( )
25℃时,用浓度为0.1000mol•L-1的NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的盐酸和醋酸溶液的滴定曲线如图所示(混合溶液体积变化忽略不计).下列说法不正确的是( )
 25℃时,用浓度为0.1000mol•L-1的NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的盐酸和醋酸溶液的滴定曲线如图所示(混合溶液体积变化忽略不计).下列说法不正确的是( )
25℃时,用浓度为0.1000mol•L-1的NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的盐酸和醋酸溶液的滴定曲线如图所示(混合溶液体积变化忽略不计).下列说法不正确的是( )| A. | 根据滴定曲线,可得Ka(CH3COOH)≈10-5 | |
| B. | pH=7时,滴定醋酸溶液消耗的V(NaOH溶液)<20mL | |
| C. | C点溶液:c(HX)>c(X-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 当V(NaOH溶液)=20mL时,A点水电离出c(H+)大于B点水电离出的c(H+) |
9.下图表示从原混合物中分离出X的两种方案,下列说法中不合理的是( )

| A. | 若含X的混合物为溴水,可通过方案Ⅰ进行分离,加入试剂为CCl4溶液,充分振荡后液体分层,下层为X的CCl4溶液 | |
| B. | 若含X的混合物为BaSO4、BaSO3的混合物,可通过方案Ⅱ进行分离得到X,加入试剂为稀硝酸,X为BaSO4 | |
| C. | 若含X的混合物为乙醇和乙酸乙酯的混合物,可通过方案Ⅰ进行分离,加入试剂为饱和NaOH溶液,残留液中含有乙酸钠 | |
| D. | 若含X的混合物为Fe、Al,可通过方案Ⅱ进行分离,加入的试剂是过量的NaOH溶液,1molX与足量氯气完全反应时,转移3mol电子 |
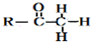 +
+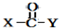 $\stackrel{OH-}{→}$
$\stackrel{OH-}{→}$