题目内容
18.铝是一种很重要的金属,可以发生一系列反应制备物质.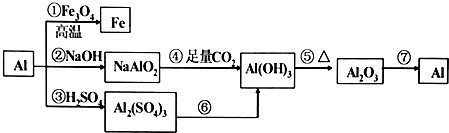
回答下列问题:
(1)反应①可以用于焊接铁轨或冶炼金属(说出一条).
(2)②③反应产生等量氢气消耗的NaOH与H2SO4的物质的量之比为2:3.
(3)反应④的离子反应的方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(4)用反应⑥制备Al(OH)3,最好是向A12(SO4)3溶液中滴加氨水,离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(5)工业上常用反应⑦制备金属铝,制备过程的方程式是2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
分析 由流程可知,①为铝热反应生成Fe和氧化铝,②为Al与NaOH溶液的反应生成偏铝酸钠和氢气,③为Al与硫酸反应生成硫酸铝和氢气,④反应生成氢氧化铝和碳酸氢钠,⑤中分解生成氧化铝和水,⑦中电解生成Al,以此来解答.
解答 解:(1)金属铝和一些金属的氧化物如氧化铁在高温下的置换反应称为铝热反应,生成的铁是液态,可以用来焊接钢轨,故答案为:焊接铁轨或冶炼金属;
(2)令生成的氢气的物质的量为3mol,则:
2Al+3H2SO4=Al2(SO4)3+3H2↑
3mol 3mol
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2mol 3mol
稀硫酸和氢氧化钠溶液的物质的量浓度相等,所以所取稀硫酸和氢氧化钠溶液的体积比等于溶质H2SO4、NaOH的物质的量的之比,即为3mol:2mol=3:2,NaOH与H2SO4的物质的量之比为2:3;故答案为:2:3;
(3)反应④是偏铝酸根离子与二氧化碳气体反应生成氢氧化铝和碳酸氢根离子,其离子反应的方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)氢氧化铝是两性氢氧化物,只能和强酸强碱反应,不与弱酸弱碱反应,故实验室制备氢氧化铝时一般用弱碱而不用强碱,故实验室制取Al(OH)3的化学方程式为:AlCl3+3NH3•H2O=Al(OH)3↓+3NH4Cl,离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;故答案为:氨水;Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(5)电解熔融的氧化铝得到单质铝和氧气,化学方程式为:2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑,故答案为:2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
点评 本题考查铝的性质、根据方程式的计算,难度不大,注意有关方程式的书写,根据方程式计算.

| A. | 按系统命名法,化合物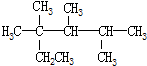 的名称是2,3,4-三甲基-2-乙基戊烷 的名称是2,3,4-三甲基-2-乙基戊烷 | |
| B. | 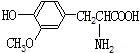 与 与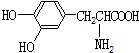 都是α-氨基酸且互为同系物 都是α-氨基酸且互为同系物 | |
| C. | 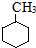 的一溴代物和 的一溴代物和 的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) | |
| D. | CH3CH═CHCH3分子中的四个碳原子在同一平面上 |
| A. | 虽然固体氯化钠不能导电,但氯化钠是电解质 | |
| B. | 在纯水中加入少量硫酸铵,可抑制水的电离 | |
| C. | 在醋酸钠溶液中加入少量氢氧化钠,溶液中 c(OH-)增大 | |
| D. | 纯水的pH随温度的升高而减小 |
| A. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ | |
| B. | 由水电离的c(H+)=10-12 mol•L-1的溶液:K+、Ba2+、Cl-、Br- | |
| C. | 在pH=1的溶液中:NH4+、K+、NO3-、Cl- | |
| D. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- |
| A. | 硅胶 | B. | 生石灰 | C. | 活性炭 | D. | 铁粉 |