题目内容
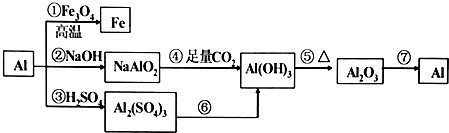
6.用化学知识解答:(1)等物质的量的钠、镁、铝与足量的盐酸反应,在相同的条件下产生氢气的体积之比是1:2:3;
(2)若产生相同体积(同温同压下)的氢气,所需钠、镁、铝的物质的量之比为6:3:2;
(3)把0.5mol钠投入到m1 g的水(过量)中得到a溶液,把0.5mol镁投入m2 g盐酸(过量)中得到b溶液,若m1=m2,则a、b的质量大小关系是a=b.
(4)把a g铝铁合金粉末溶于足量盐酸中,再加入过量氢氧化钠溶液.过滤出沉淀,经洗涤、干燥、灼烧.得到红棕色粉末的质量仍为a g,则此合金中铝的质量分数为30%
(5)把 a mol Na和a mol Al一同投入到m g足量水中,所得溶液密度为d g/L,该溶液里溶质的物质的量浓度为$\frac{ad}{m+46a}$mol/L.
分析 (1)(2)发生反应:2Na+2HCl=2NaCl+H2↑、Mg+HCl=MgCl2+H2↑、2Al+6HCl=AlCl3+3H2↑,根据方程式计算解答;
(3)反应后的溶液质量增重=金属质量-生成氢气的质量,计算溶液质量增重进行判断;
(4)a g铝铁合金粉末溶于足量盐酸中,加入过量NaOH 溶液,沉淀经洗涤、干燥、灼烧,得到红棕色粉末为氧化铁,氧化铁质量等于合金的质量,利用组成可知氧化铁中氧元素的质量等于合金中铝的质量,以此来解答;
(5)发生总反应为:Na+Al+2H2O=NaAlO2+2H2↑,等物质的量的Na、Al恰好反应,最终恰好为NaAlO2溶液,根据方程式计算n(NaAlO2)、n(H2),进而计算溶液的质量,根据V=$\frac{m}{ρ}$计算溶液体积,再根据c=$\frac{n}{V}$计算偏铝酸钠的浓度.
解答 解:(1)分别取0.1mol钠、镁、铝与足量盐酸反应,则:
2Na+2HCl=2NaCl+H2↑、Mg+HCl=MgCl2+H2↑、2Al+6HCl=AlCl3+3H2↑,
0.1mol 0.05mol 0.1mol 0.1mol 0.1mol 0.15mol
故在相同条件下产生氢气的体积比=0.05mol:0.1mol:0.15mol=1:2:3,
故答案为:1:2:3;
(2)产生相同物质的量的氢气,设氢气为3mol,则:
2Na+2HCl=2NaCl+H2↑、Mg+HCl=MgCl2+H2↑、2Al+6HCl=AlCl3+3H2↑,
6mol 3mol 3mol 3mol 2mol 3mol
故所需钠、镁、铝的物质的量之比=6mol:3mol:2mol=6:3:2,
故答案为:6:3:2;
(3)把0.5mol钠投入到m1g水(过量)中,则:
2Na+2H2O=2NaOH+H2↑
0.5mol 0.25mol
故溶液质量增重=0.5mol×23g/mol-0.25mol×2g/mol=11g,
把0.5mol镁投入到m2g盐酸(过量)中,则:
Mg+HCl=MgCl2+H2↑
0.5mol 0.5mol
故溶液质量增重=0.5mol×24g/mol-0.5mol×2g/mol=11g,
由于m1=m2,则所得溶液质量相等,即a=b,
故答案为:a=b;
(4)由铝铁合金粉末溶于足量盐酸中,加入过量NaOH 溶液,沉沉经洗涤、干燥、灼烧,得到红棕色粉末为氧化铁,氧化铁质量等于合金的质量,利用组成可知氧化铁中氧元素的质量等于合金中铝的质量,则合金中Al的质量分数等于氧化铁中氧的质量分数=$\frac{16×3}{160}$×100%=30%,故答案为:30%;
(5)发生总反应为:Na+Al+2H2O=NaAlO2+2H2↑,等物质的量的Na、Al恰好反应,最终恰好为NaAlO2溶液,由方程式可知n(NaAlO2)=amol、n(H2)=2amol,故m(H2)=2a mol×2g/mol=4ag,则溶液的质量为(mg+amol×23g/mol+amol×27g/mol)-4ag=(m+46a)g,故溶液的体积为$\frac{m+46a}{d}$L,故所得偏铝酸钠溶液的浓度为$\frac{amol}{\frac{m+46a}{d}L}$=$\frac{ad}{m+46a}$mol/L,故答案为:$\frac{ad}{m+46a}$.
点评 本题考查根据方程式进行的计算,比较基础,利用电子转移守恒进行更为简单,(3)中注意根据溶液质量增重进行解答.

 名校课堂系列答案
名校课堂系列答案| A. | 7.8gNa2O2中含有的阴离子数是0.2NA | |
| B. | 常温常压下,8gO2含有的电子数是4NA | |
| C. | 标准状况下,2.24LCCl4中含有分子数为0.1NA | |
| D. | 1L1.0mol•L-1Na2CO3溶液中含有的氧原子数为3NA |
| A. | 普通漏斗、玻璃棒、烧杯 | B. | 长颈漏斗、玻璃棒、烧杯 | ||
| C. | 大试管、试管夹、容量瓶 | D. | 分液漏斗、烧杯、铁架台 |
| A. | 高温结构陶瓷属于新型无机非金属材料,可以作为高级耐火材料 | |
| B. | 氧化铝陶瓷属于新型无机非金属材料,它是生物陶瓷 | |
| C. | 氮化硅陶瓷属于新型无机非金属材料,可用于制造陶瓷发动机的受热面 | |
| D. | 新型无机非金属材料克服了传统无机非金属材料的缺点,但是强度比较差 |
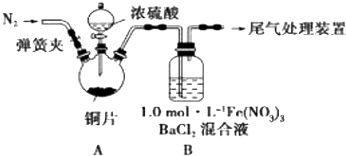
| A. | 向溶液中滴加BaCl2溶液产生白色沉淀再加稀盐酸沉淀不溶解,则证明原溶液中含有SO42- | |
| B. | 向溶液中加入稀盐酸,产生了能使澄清石灰水变浑浊的气体,则证明原溶液中含有CO32- | |
| C. | 向溶液中滴加NaOH溶液,并将湿润的红色石蕊试纸放在试管口发现试纸不变蓝,则证明原溶液中没有NH4+ | |
| D. | 向溶液中先滴加KSCN溶液不变色,后滴加氯水溶液变红,则证明原溶液中含有Fe2+ |
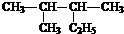 2,3-二甲基戊烷;
2,3-二甲基戊烷;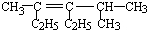 3,5-二甲基-4-乙基-3-己烯.
3,5-二甲基-4-乙基-3-己烯.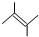 .
.