题目内容
(1)有A、B、C、D四种短周期主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,B元素原子的核外p电子数比s电子数少1,C为金属元素且原子核外p电子数和s电子数相等;D元素的原子核外所有p轨道为全满或半满.
①写出四种元素的元素名称
A: B: C:
②写出D元素基态原子核外价子排布的轨道表示式:D: .
(2)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
A通常显 价,第一电离能A B(填“<”,“>”,“=”)
①写出四种元素的元素名称
A:
②写出D元素基态原子核外价子排布的轨道表示式:D:
(2)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:(1)有A、B、C、D四种短周期的主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,则A为氢元素;B元素原子的核外p轨道电子数比s轨道电子数少1,B原子核外电子排布为1s22s22p3,为N元素;C为金属元素且原子核外p轨道电子数和s轨道电子数相等,原子序数大于氮元素,处于第三周期,核外电子排布为1s22s22p63s2,则C为Mg元素,D元素的原子核外所有p轨道全满或半满,原子序数大于Mg,则核外电子排布为1s22s22p63s23p3,则D为P元素;
(2)由电离能可知,A可失去3个电子,最高化合价为+3价,B可失去2个电子,最高化合价为+2价,则A为Al,B为Mg,第一电离能大小取决于金属性强弱,金属性强弱主要是指失去电子的能力的强弱,镁最外层只有两个电子,更容易失去,所以镁金属性更强,据此分析即可.
(2)由电离能可知,A可失去3个电子,最高化合价为+3价,B可失去2个电子,最高化合价为+2价,则A为Al,B为Mg,第一电离能大小取决于金属性强弱,金属性强弱主要是指失去电子的能力的强弱,镁最外层只有两个电子,更容易失去,所以镁金属性更强,据此分析即可.
解答:
解:依据分析可知:A为H,B为N,C为Mg,D为P,
(1)①A为H,B为N,C为Mg,故答案为:氢;氮;镁;
②D元素为P,P的基态原子核外价电子排布的轨道表示式为p,故答案为p;
(2)由电离能可知,A可失去3个电子,最高化合价为+3价,B可失去2个电子,最高化合价为+2价,AB属于第三周期元素,则A为Al,B为Mg,同周期元素从左到右元素的第一电离能由表格可知,738>578,即Mg>Al,
故答案为:+3;<.
(1)①A为H,B为N,C为Mg,故答案为:氢;氮;镁;
②D元素为P,P的基态原子核外价电子排布的轨道表示式为p,故答案为p;
(2)由电离能可知,A可失去3个电子,最高化合价为+3价,B可失去2个电子,最高化合价为+2价,AB属于第三周期元素,则A为Al,B为Mg,同周期元素从左到右元素的第一电离能由表格可知,738>578,即Mg>Al,
故答案为:+3;<.
点评:本题考查结构性质位置关系、常用化学用语,难度不大,掌握核外电子排布规律是推断的关键.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
下列叙述正确的是( )
| A、同周期元素中,ⅦA族元素的原子半径最大 |
| B、ⅠA族元素的原子,其半径越大,越容易得到电子 |
| C、室温时,零族元素的单质都是气体 |
| D、所有主族元素的原子,形成单原子离子时的化合价与它的族序数相等 |
化学用语在化学学科中作用非常重要,以下有关化学用语描述正确的是( )
A、Mg2+的结构示意图: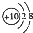 |
B、Na2S的电子式: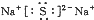 |
| C、氨气的空间结构:三角形 |
| D、乙烯的结构简式:(CH2)2 |
一定温度下,反应2SO2(g)+O2(g)?2SO3(g),达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4.缩小体积,反应再次达到平衡时,n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量应是( )
| A、0.4 mol |
| B、0.6 mol |
| C、0.8 mol |
| D、1.2 mol |

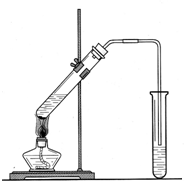
 为了证明铜与稀硝酸反应产生的是NO,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,
为了证明铜与稀硝酸反应产生的是NO,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,




