题目内容
一定温度下,反应2SO2(g)+O2(g)?2SO3(g),达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4.缩小体积,反应再次达到平衡时,n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量应是( )
| A、0.4 mol |
| B、0.6 mol |
| C、0.8 mol |
| D、1.2 mol |
考点:化学平衡的计算
专题:
分析:反应平衡后SO2、O2、SO3的物质的量之比是2:3:4,保持其它条件不变,缩小体积达到新的平衡时,O2 、SO3的物质的量分别为0.8mol和1.4mol,产生SO3、O2的物质的量之比是1.4:0.8=1.75:1>4:3,说明缩小体积平衡向正反应方向移动,设改变体积后生成的SO3的物质的量为xmol,根据方程式用x表示出SO3、O2的物质的量的变化量,进而表示与原平衡时SO3、O2的物质的量,根据原平衡时SO3、O2的物质的量的之比为4:3列方程计算x值,进而计算原平衡时SO3的物质的量,平衡时SO3的物质的量加上改变体积生成的SO3的物质的量为新平衡SO3的物质的量.
解答:
解:反应平衡后SO2、O2、SO3的物质的量之比是2:3:4,保持其它条件不变,缩小体积达到新的平衡时,O2 、SO3的物质的量分别为0.8mol和1.4mol,产生SO3、O2的物质的量之比是1.4:0.8=1.75:1>4:3,说明缩小体积平衡向正反应方向移动,改变体积达到新的平衡时,SO3、O2的物质的量分别为1.4mol和0.8mol,说明缩小体积平衡向正反应方向移动,
设改变体积后生成的SO3的物质的量为xmol,则:
2SO2(g)+O2(g)?2SO3(g)
xmol 0.5xmol xmol
故(1.4mol-xmol):(0.8mol+0.5xmol)=4:3,解得x=0.2,
故原平衡时SO3的物质的量=1.4mol-0.2mol=1.2mol,
则原平衡时SO2的物质的量=1.2mol×
=0.6mol,
故到达新平衡SO2的物质的量=0.6mol-0.2mol=0.4mol,
故选:A.
设改变体积后生成的SO3的物质的量为xmol,则:
2SO2(g)+O2(g)?2SO3(g)
xmol 0.5xmol xmol
故(1.4mol-xmol):(0.8mol+0.5xmol)=4:3,解得x=0.2,
故原平衡时SO3的物质的量=1.4mol-0.2mol=1.2mol,
则原平衡时SO2的物质的量=1.2mol×
| 1 |
| 2 |
故到达新平衡SO2的物质的量=0.6mol-0.2mol=0.4mol,
故选:A.
点评:本题考查化学平衡的有关计算,难度中等,根据SO2、O2的物质的量比例关系判断平衡移动方向是解题的关键.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
欲配制100ml 0.10mol/L的KCl溶液,需要使用的仪器有( )
| A、玻璃棒 | B、烧杯 |
| C、分液漏斗 | D、100ml容量瓶 |
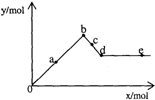 已知Ba(AlO2)2可溶于水.如图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是( )
已知Ba(AlO2)2可溶于水.如图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是( )| A、a-b时沉淀的物质的量:A1(OH)3比BaSO4多 |
| B、c-d时溶液中离子的物质的量:AlO2-比Ba2+多 |
| C、a-d时沉淀的物质的量:BaSO4可能小于A1(OH)3 |
| D、d-e时溶液中离子的物质的量:Ba2+不可能等于OH- |
