题目内容
4.常温下,下列各组离子在指定溶液中一定能大量共存的是( )| A. | c(H+)=$\sqrt{{K}_{W}}$mol•L-1的溶液:Fe3+、K+、Cl-、CO32- | |
| B. | c(NH4+)=0.1mol•L-1的(NH4)2Fe(SO4)2溶液:H+、Al3+、Br-、I- | |
| C. | 加水稀释时,$\frac{c(O{H}^{-})}{c({H}^{+})}$值明显增大的溶液:K+、NH4+、CO32-、MnO4- | |
| D. | 通入SO2的饱和溶液:Ca2+、K+、NO3-、Cl- |
分析 A.c(H+)=$\sqrt{{K}_{W}}$mol•L-1的溶液呈中性,铁离子与碳酸根离子发生双水解反应,铁离子只能存在于酸性溶液,碳酸根离子只能存在于碱性溶液;
B.c(NH4+)=0.1mol•L-1的(NH4)2Fe(SO4)2溶液中,四种离子之间不反应,都不与(NH4)2Fe(SO4)2反应;
C.该溶液呈酸性,碳酸根离子与氢离子反应;
D.酸性条件下硝酸根离子能够氧化二氧化硫.
解答 解:A.c(H+)=$\sqrt{{K}_{W}}$mol•L-1的溶液呈中性,Fe3+与CO32-发生双水解反应,Fe3+只能存在于酸性溶液,CO32-只能存在于碱性溶液,故A错误;
B.H+、Al3+、Br-、I-之间不发生反应,都不与(NH4)2Fe(SO4)2反应,在溶液中能够大量共存,故B正确;
C.该溶液呈酸性,溶液中存在大量氢离子,CO32-与氢离子反应,在溶液中不能大量共存,故C错误;
D.SO2的饱和溶液中,NO3-与SO2在溶液中发生氧化还原反应,不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
14.将X气体通入Y溶液中,实验结果与预测的现象一致的组合是( )
| 选项 | X气体 | Y溶液 | 预测的现象 |
| ① | CO2 | BaCl2溶液 | 白色沉淀析出 |
| ② | SO2 | Ba(N03)2溶液 | 白色沉淀析出 |
| ③ | Cl2 | AgNO3溶液 | 白色沉淀析出 |
| ④ | NH3 | FeCl2溶液 | 白色沉淀产生 |
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
15.下列每个选项的甲乙两个反应中,属于同一种反应类型的是( )
| 选项 | 甲 | 乙 |
| A | 溴乙烷水解制备乙醇 | 乙烯水化制备乙醇 |
| B | 甲烷与氯气反应制备四氯化碳 | 乙烯通入KMnO4溶液中 |
| C | 甲苯与KMnO4溶液反应生成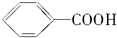 | 苯与液溴反应制备溴苯 |
| D | 蛋白质水解得到氨基酸 | 乙醇与冰醋酸反应生成乙酸乙酯 |
| A. | A | B. | B | C. | C | D. | D |
12.将盛有12mL NO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积和剩余的2mL气体分别是( )
| A. | 1.2 mL,NO | B. | 2.4 mL,O2 | C. | 3.5 mL,O2 | D. | 4 mL,NO |
19.下列操作中正确的是( )
| A. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 | |
| B. | 浓硫酸沾在皮肤上时应用大量水冲洗,再涂上3%~5%的NaOH溶液 | |
| C. | 实验室进行蒸馏操作时若忘加了沸石,应停止反应冷却至室温后再加入 | |
| D. | 配制硫酸溶液时,可先在量筒中加一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
9.下列萃取和分液结合进行的操作(用CCl4从碘水中萃取碘)中错误的是( )
| A. | 饱和碘水和CCl4加入分液漏斗中后,盖上玻璃塞,用右手压住分液漏斗玻璃塞,左手握住活塞部分,把分液漏斗倒转过来振荡 | |
| B. | 静置前,先使分液漏斗内外空气相通,溶液分层 | |
| C. | 打开分液漏斗的活塞,使下层液体沿烧杯内壁慢慢流出,下层液体放完时立即关闭活塞 | |
| D. | 最后再打开分液漏斗的活塞,放出并保存上层液 |
13.根据元素周期律及元素周期表的知识分析,下列关系中不正确的是( )
| A. | 酸性强弱:H3PO4>H2SO4>HClO4 | B. | 离子半径大小:F->Na+>Mg2+>Al3+ | ||
| C. | 稳定性大小:SiH4<PH3<H2S<HCl | D. | 碱性强弱:NaOH>Mg(OH)2>Al(OH)3 |
14.下列实验方案能达到实验目的是( )
| 实验目的 | 实验方案 | |
| A | 证明溴乙烷发生消去反应有 乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液, 加热,将反应产生的气体通入溴的四氯化碳溶液 |
| B | 证明HCOOH结构中含有醛 基 | 将1mL 1mol/L HCOOH溶液加入装有银氨溶液 的试管中并水浴加热,观察有无银镜产生 |
| C | 除去甲烷中的乙烯 | 将混合气通入KMnO4溶液中洗气 |
| D | 制取乙烯气体 | 将无水乙醇和浓硫酸混合加热到140℃ |
| A. | A | B. | B | C. | C | D. | D |