题目内容
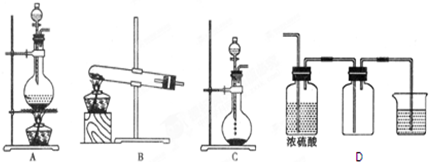
9.下列萃取和分液结合进行的操作(用CCl4从碘水中萃取碘)中错误的是( )| A. | 饱和碘水和CCl4加入分液漏斗中后,盖上玻璃塞,用右手压住分液漏斗玻璃塞,左手握住活塞部分,把分液漏斗倒转过来振荡 | |
| B. | 静置前,先使分液漏斗内外空气相通,溶液分层 | |
| C. | 打开分液漏斗的活塞,使下层液体沿烧杯内壁慢慢流出,下层液体放完时立即关闭活塞 | |
| D. | 最后再打开分液漏斗的活塞,放出并保存上层液 |
分析 A.碘不易溶于水,易溶于四氯化碳,在分液漏斗中萃取、分液;
B.使分液漏斗内外空气相通保证液体顺利流出;
C.下层液体从下口流出,上层液体从上口倒出;
D.分液漏斗不能长时间保存液体.
解答 解:A.碘不易溶于水,易溶于四氯化碳,在分液漏斗中萃取、分液,则用右手压住分液漏斗玻璃塞,左手握住活塞部分,把分液漏斗倒转过来振荡,然后静置,操作合理,故A正确;
B.使分液漏斗内外空气相通,平衡内外气压,溶液分层后保证液体顺利流出,故B正确;
C.分液操作时,分液漏斗中下层液体从下口放出,下层液体放完时立即关闭活塞,上层液体从上口倒出,以免两种液体相互污染,故C正确;
D.分液漏斗不能保存液体,应在细口瓶中保存,故D错误,
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯实验、实验技能为解答的关键,侧重分析与实验能力的考查,注意萃取、分液的仪器及原理,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.下列除杂(括弧内为杂质气体)试剂和方法不正确的是( )
| 序号 | 气体 | 除杂试剂 |
| A | CO2(HCl) | 盛饱和NaHCO3溶液的吸气瓶 |
| B | Cl2(HCl) | 盛饱和食盐水的吸气瓶 |
| C | NH3(H2O) | 盛碱石灰的球形干燥管 |
| D | SO2(HCl) | 盛饱和AgNO3溶液的吸气瓶 |
| A. | A | B. | B | C. | C | D. | D |
17.下列物质的名称和主要成分的化学式对应不正确的是( )
| A. | 石膏(CaSO4•2H2O) | B. | 硫铁矿(FeS2) | ||
| C. | 纯碱(NaHCO3) | D. | 芒硝(Na2SO4•10H2O) |
4.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | c(H+)=$\sqrt{{K}_{W}}$mol•L-1的溶液:Fe3+、K+、Cl-、CO32- | |
| B. | c(NH4+)=0.1mol•L-1的(NH4)2Fe(SO4)2溶液:H+、Al3+、Br-、I- | |
| C. | 加水稀释时,$\frac{c(O{H}^{-})}{c({H}^{+})}$值明显增大的溶液:K+、NH4+、CO32-、MnO4- | |
| D. | 通入SO2的饱和溶液:Ca2+、K+、NO3-、Cl- |
1.根据化学反应3NO2+H2O→2HNO3+X,推断X的化学式为( )
| A. | NO | B. | N2 | C. | N2O3 | D. | N2O5 |
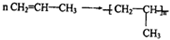 ,该反应的反应类型为加聚反应.
,该反应的反应类型为加聚反应.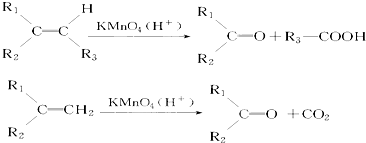
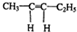 .若该烯烃的一种同分异构体与酸性高锰酸钾溶液反应得到的产物为二氧化碳和丁酮(
.若该烯烃的一种同分异构体与酸性高锰酸钾溶液反应得到的产物为二氧化碳和丁酮(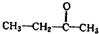 ),则此烯烃的结构简式为
),则此烯烃的结构简式为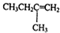 ,名称为2-甲基-1-丁烯;丁酮中官能团的名称为羰基.
,名称为2-甲基-1-丁烯;丁酮中官能团的名称为羰基.