题目内容
12.将14g铁粉投入到500mL某稀硝酸中,经充分反应后,测得Fe和HNO3均无剩余.已知反应放出的气体在标准状况下为4.48L.假定反应前后溶液的体积不变且还原产物只有一种,则原硝酸的物质的量浓度是( )| A. | 0.8 mol•L-1 | B. | 1.6 mol•L-1 | C. | 1.4 mol•L-1 | D. | 0.75 mol•L-1 |
分析 将14g铁粉投入到500mL某稀硝酸中,充分反应后,还原产物只有一种即产生的是NO,金属铁粉和硝酸之间的反应分为铁过量和不足两种情况,可以根据一氧化氮的物质的量确定是哪种情况;根据电子守恒和元素守恒设未知数进行计算即可.
解答 解:铁与稀硝酸可能发生反应:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O、3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,
由反应放出的气体在标准状况下为4.48L,即n(NO)=0.2mol,
n(Fe)=$\frac{14g}{56g/mol}$=0.25mol,如生成Fe(NO3)3,则生成0.25molNO,如生成Fe(NO3)2,则生成0.25mol×$\frac{2}{3}$≈0.17mol,则说明生成Fe(NO3)3和Fe(NO3)2,
令Fe(NO3)3和Fe(NO3)2物质的量分别为xmol、ymol,根据Fe元素守恒及电子转移守恒,可得:x+y=0.25,3x+2y=0.2×3,解得x=0.1、y=0.15,
根据N元素守恒可知,n(HNO3)=3n[Fe(NO3)3]+2n[Fe(NO3)2]+n(NO)=3×0.1mol+2×0.15mol+0.2mol=0.8mol,则原硝酸的物质的量浓度=$\frac{0.8mol}{0.5L}$=1.6mol/L,
故选B.
点评 本题考查学生金属铁和硝酸之间的反应情况,注意元素守恒和电子守恒的应用是重点,难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示,关于咖啡鞣酸的下列叙述正确的是( )


| A. | 分子式为C16H18O9 | |
| B. | 1mol咖啡鞣酸水解时可消耗8mol NaOH | |
| C. | 1mol 咖啡鞣酸最多可消耗Br2 6 mol | |
| D. | 能发生取代反应和加成反应,但不能消去反应 |
20.下列化学用语正确的是( )
| A. | 2-乙基-1,3-丁二烯分子的键线式: | B. | 丙烷分子的比例模型: | ||
| C. | 甲醛的电子式: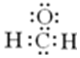 | D. | 聚丙烯的结构简式: |
7.对于有机物 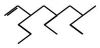 命名正确的是( )
命名正确的是( )
 命名正确的是( )
命名正确的是( )| A. | 5,7-二甲基-3-乙基-1-辛烯 | B. | 3-乙基-5,7-二甲基-1-壬烯 | ||
| C. | 3-甲基-5-乙基-7-丙基-8-壬烯 | D. | 7-甲基-5-乙基-3-丙基-1-壬烯 |
17.下列关于丙烯(CH3-CH=CH2)的说法不正确的( )
| A. | 丙烯分子有8个σ键,1个π键 | |
| B. | 丙烯分子中碳原子有两种杂化方式 | |
| C. | 丙烯分子至少有六个原子在同一平面上 | |
| D. | 丙烯分子中3个碳原子在同一直线上 |
4.某有机物的分子式为C5H10O,它能发生银镜反应和加成反应,若将它与H2加成,所得产物结构简式可能是( )
| A. | (CH3)3CCH2OH | B. | (CH3CH2)2CHOH | C. | CH3(CH2)2CH(CH3)OH | D. | CH3CH2C(CH3)2OH |
2.金属钒及其化合物有着广泛的应用,现有如下回收利用含钒催化剂[含有V2O5、VOSO4(强电解质)及不溶性残渣]的工艺的主要流程:

部分含钒物质在水中的溶解性如表所示:
请回答下列问题:
(1)工业上常用铝热反应由V2O5冶炼金属钒,化学方程式为3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V.
(2)反应①、②、③、④中,发生氧化还原反应的是①②(填序号),写出反应①的离子方程式V2O5+SO32-+4H+=2VO2++SO42-+2H2O.操作1、操作2用到的玻璃仪器是烧杯、玻璃棒、漏斗.
(3)反应③的沉淀率(又称沉钒率)是回收钒的关键之一,图2是反应温度与沉钒率的关系图,则控制温度的方法是将反应容器置于80℃的水浴中.

(4)反应④在焙烧过程中随温度的升高发生了两步反应.已知234gNH4VO3固体质量的减少值△W随温度(T)变化的曲线如图3.试写出300℃~350℃时反应的化学方程式2HVO3 $\frac{\underline{\;300°C-350°C\;}}{\;}$V2O5+H2O.
(5)全钒电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+.电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+.

部分含钒物质在水中的溶解性如表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 | HVO3 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 | 难溶 |
(1)工业上常用铝热反应由V2O5冶炼金属钒,化学方程式为3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V.
(2)反应①、②、③、④中,发生氧化还原反应的是①②(填序号),写出反应①的离子方程式V2O5+SO32-+4H+=2VO2++SO42-+2H2O.操作1、操作2用到的玻璃仪器是烧杯、玻璃棒、漏斗.
(3)反应③的沉淀率(又称沉钒率)是回收钒的关键之一,图2是反应温度与沉钒率的关系图,则控制温度的方法是将反应容器置于80℃的水浴中.

(4)反应④在焙烧过程中随温度的升高发生了两步反应.已知234gNH4VO3固体质量的减少值△W随温度(T)变化的曲线如图3.试写出300℃~350℃时反应的化学方程式2HVO3 $\frac{\underline{\;300°C-350°C\;}}{\;}$V2O5+H2O.
(5)全钒电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+.电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+.
