题目内容
20.下列化学用语正确的是( )| A. | 2-乙基-1,3-丁二烯分子的键线式: | B. | 丙烷分子的比例模型: | ||
| C. | 甲醛的电子式: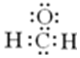 | D. | 聚丙烯的结构简式: |
分析 A.键线式表示方法:碳碳键用线段来表现,画出键线式,拐点和端点表示碳原子,碳原子,H不必标出,杂原子(非碳、氢原子)不得省略,并且其上连有的氢也一般不省略;
B.比例模型主要体现出各原子的相对体积大小,题中为球棍模型;
C.甲醛分子中存在的是碳氧双键;
D.丙烯不饱和的C=C双键其中一个键断开,自身加成反应生成聚丙烯,聚丙烯结构单元的主链含有2个C原子.
解答 解:A.2-乙基-1,3-丁二烯的结构简式为CH2=C(CH2CH3)-CH=CH2,分子中的碳氢键、碳原子及与碳原子相连的氢原子均省略后得键线式 ,故A正确;
,故A正确;
B. 为丙烷的球棍模型,丙烷的比例模型为
为丙烷的球棍模型,丙烷的比例模型为 ,故B错误;
,故B错误;
C.甲醛中存在碳氧双键,其正确的电子式为 ,故C错误;
,故C错误;
D.聚丙烯为丙烯通过加聚反应生成的,其正确的结构简式为: ,故D错误;
,故D错误;
故选A.
点评 本题考查常见化学用语的书写原则,题目难度不大,涉及电子式、结构简式、球棍模型与比例模型、键线式等知识,明确常见化学用语的书写原则为解答关键,试题有利于提高学生的规范答题能力.

练习册系列答案
相关题目
10.下列物质中,含有共价键的离子化合物的是( )
| A. | CaCl2 | B. | KOH | C. | H2SO4 | D. | CH3Cl |
11.下表是元素周期表的一部分,回答下列有关问题:
(1)写出元素⑩符号:As;画出原子的结构示意图:⑦ .
.
(2)从⑤到⑨元素中非金属性较强的元素是Cl(用元素符号表示),这些元素的最高价氧化物对应的水化物中碱性最强的是NaOH (填化学式)
(3)写出元素④氢化物的电子式: 或
或
(4)写出一种由①、③、④三种元素形成的常见离子化合物:NH4NO3或NH4NO2
(5)用电子式表示⑥、⑨形成化合物的过程: .
.
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ |
 .
.(2)从⑤到⑨元素中非金属性较强的元素是Cl(用元素符号表示),这些元素的最高价氧化物对应的水化物中碱性最强的是NaOH (填化学式)
(3)写出元素④氢化物的电子式:
 或
或
(4)写出一种由①、③、④三种元素形成的常见离子化合物:NH4NO3或NH4NO2
(5)用电子式表示⑥、⑨形成化合物的过程:
 .
.
8.已知最简单的有机物E和直线型分子G在光照条件下反应,生成四面体型分子L和直线型分子M(组成G分子的元素为第三周期的元素),如图.则下列判断错误的是( )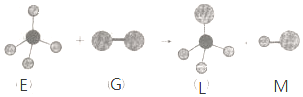

| A. | 常温常压下,E是一种无色无味的气体 | |
| B. | 干燥的G能漂白有色物质 | |
| C. | 在光照条件L能与 G继续发生与上述类似的反应 | |
| D. | 上述反应类型是取代反应 |
15.下列叙述中,正确的是( )
| A. | 氨水显碱性 | B. | 铵盐不易溶于水 | ||
| C. | 氨气可以用浓硫酸进行干燥 | D. | NH3+HCl═NH4Cl属于氧化还原反应 |
12.将14g铁粉投入到500mL某稀硝酸中,经充分反应后,测得Fe和HNO3均无剩余.已知反应放出的气体在标准状况下为4.48L.假定反应前后溶液的体积不变且还原产物只有一种,则原硝酸的物质的量浓度是( )
| A. | 0.8 mol•L-1 | B. | 1.6 mol•L-1 | C. | 1.4 mol•L-1 | D. | 0.75 mol•L-1 |
9.已知下列反应:Cu+X2→CuX2、2Cu+Y→Cu2Y、2X-+Z2→2Z-+X2,X2、Y、Z2为三种元素的单质,在Cu2Y中,Y为-2价.下列关于X、Y、Z三种元素的最高价氧化物的水化物酸性由强到弱顺序正确的是( )
| A. | HXO4>H2YO4>HZO4 | B. | HZO4>HXO4>H2YO4 | C. | HZO4>H2YO4>HXO4 | D. | H2YO4>HZO4>HXO4 |
10.X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如表所示.Z元素原子核外K层与M层电子数相等.下列说法中正确的是( )
| X | Y | ||
| Z | W |
| A. | 金属性由强到弱的顺序为:Z、W | |
| B. | 原子半径由大到小的顺序为:Y、Z | |
| C. | 简单气态氢化物的稳定性由强到弱的顺序:X、Y | |
| D. | 工业上常用电解熔融Z的氧化物得到单质Z |
