题目内容
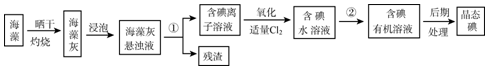
2.金属钒及其化合物有着广泛的应用,现有如下回收利用含钒催化剂[含有V2O5、VOSO4(强电解质)及不溶性残渣]的工艺的主要流程:
部分含钒物质在水中的溶解性如表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 | HVO3 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 | 难溶 |
(1)工业上常用铝热反应由V2O5冶炼金属钒,化学方程式为3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V.
(2)反应①、②、③、④中,发生氧化还原反应的是①②(填序号),写出反应①的离子方程式V2O5+SO32-+4H+=2VO2++SO42-+2H2O.操作1、操作2用到的玻璃仪器是烧杯、玻璃棒、漏斗.
(3)反应③的沉淀率(又称沉钒率)是回收钒的关键之一,图2是反应温度与沉钒率的关系图,则控制温度的方法是将反应容器置于80℃的水浴中.

(4)反应④在焙烧过程中随温度的升高发生了两步反应.已知234gNH4VO3固体质量的减少值△W随温度(T)变化的曲线如图3.试写出300℃~350℃时反应的化学方程式2HVO3 $\frac{\underline{\;300°C-350°C\;}}{\;}$V2O5+H2O.
(5)全钒电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+.电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+.
分析 废钒催化剂粉碎、水浸,将溶解性物质溶于水,然后过滤得到滤渣和滤液,根据溶解性表知,滤液中含有VOSO4,滤渣中含有V2O5等不溶性杂质,向滤渣中加入亚硫酸钠和稀硫酸,亚硫酸钠具有还原性,能将V2O5还原为VOSO4,然后过滤得到滤渣和滤液,将两部分滤液混合并加入氯酸钾,氯酸钾具有氧化性,能将VOSO4氧化为(VO2)2SO4,调节溶液pH为8且采用离子交换方法得到VO3-,向溶液中加入氯化铵,得到难溶性的NH4VO3,焙烧NH4VO3得到V2O5,
(1)工业由V2O5冶炼金属钒常用铝热剂法,铝和五氧化二钒在高温下发生置换反应生成V,根据反应物、生成物及反应条件书写方程式;
(2)反应过程中元素化合价变化的为氧化还原反应,反应①发生的反应是亚硫酸钠具有还原性,能将V2O5还原为VOSO4,操作1、操作2是过滤操作,据此判断用到的玻璃仪器;
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,铵根离子和VO3-反应生成难溶性的NH4VO3,根据图知,在80℃时沉降率最,图象可知沉钒率在80°C最高;
(4)NH4VO3在焙烧变化的图象和质量变化分析判断,根据NH4VO3在焙烧变化的图象可知:
2NH4VO3═V2O5+2NH3↑+H2O
234g 34g 18g
减少值开始为0~17g,曲线到200℃时(约为16.0g)曲线开始平直;到约为300℃时又开始减少(H2O的质量),到350℃时减少24g时就不再变化;
(5)电池充电时阳极上VO2+失电子发生氧化反应;
解答 解:(1)工业由V2O5冶炼金属钒常用铝热剂法,铝和五氧化二钒在高温下发生置换反应生成V,根据反应物、生成物及反应条件知,该反应方程式为3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V,
故答案为:3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V;
(2)反应①、②、③、④中,反应①是向滤渣中加入亚硫酸钠和稀硫酸,亚硫酸钠具有还原性,能将V2O5还原为VOSO4,反应②发生氧化还原反应的是将两部分滤液混合并加入氯酸钾,氯酸钾具有氧化性,能将VOSO4氧化为(VO2)2SO4,为氧化还原反应,反应③调节溶液pH为8且采用离子交换方法得到VO3-,向溶液中加入氯化铵,得到难溶性的NH4VO3,属于复分解反应,反应④是焙烧NH4VO3得到V2O5,元素化合价未变不是氧化还原反应,氧化还原反应为①②,反应①的离子方程式为:V2O5+SO32-+4H+=2VO2++SO42-+2H2O,操作1、操作2是过滤操作,用到的玻璃仪器是:烧杯、玻璃棒、漏斗,
故答案为:①②;V2O5+SO32-+4H+=2VO2++SO42-+2H2O;烧杯、玻璃棒、漏斗;
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,铵根离子和VO3-反应生成难溶性的NH4VO3,离子方程式为NH4++VO3-=NH4VO3↓,根据图知,在80℃时沉降率最大,控制温度的方法是:将反应容器置于80℃的水浴中,
故答案为:将反应容器置于80℃的水浴中;
(4)根据NH4VO3在焙烧变化的图象可知:
2NH4VO3═V2O5+2NH3↑+H2O
234g 34g 18g
减少值开始为0~17g,曲线到200℃时(约为16.0g)曲线开始平直;到约为300℃时又开始减少(H2O的质量),到350℃时减少24g时就不再变化,所以NH4VO3在焙烧过程中200℃时左右先失去氨生成HVO3;HVO3在300~350℃再失去水生成V2O5,反应的化学方程式为:2HVO3$\frac{\underline{\;300°C-350°C\;}}{\;}$V2O5+H2O,
故答案为:2HVO3$\frac{\underline{\;300°C-350°C\;}}{\;}$V2O5+H2O
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+.电池充电时阳极上VO2+失电子发生氧化反应,电极反应式为VO2++H2O-e-=VO2++2H+,
故答案为:VO2++H2O-e-=VO2++2H+.
点评 本题考查物质的分离和提纯,为高频考点,侧重考查氧化还原反应、离子反应方程式的书写、原电池和电解池原理等知识点,明确反应原理是解本题关键,知道流程图中发生的反应及实验基本操作,难点是电极反应式的书写,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 0.8 mol•L-1 | B. | 1.6 mol•L-1 | C. | 1.4 mol•L-1 | D. | 0.75 mol•L-1 |
| X | Y | ||
| Z | W |
| A. | 金属性由强到弱的顺序为:Z、W | |
| B. | 原子半径由大到小的顺序为:Y、Z | |
| C. | 简单气态氢化物的稳定性由强到弱的顺序:X、Y | |
| D. | 工业上常用电解熔融Z的氧化物得到单质Z |
| A. | 放电时Pb为负极,此时溶液中的SO42-向Pb电极迁移 | |
| B. | 铅蓄电池电解CuCl2溶液,若制得2.24LCl2(标准状况),这时电池内消耗的H2SO4至少0.2mol | |
| C. | 放电完全后铅蓄电池可进行充电,此时铅蓄电池的负极连接外电源的正极上 | |
| D. | 充电时阳极的电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42- |

(1)氧化铜矿石粉碎的目的是增大接触面积,加快化学反应速率.氧化时加入的KMnO4的作用是做氧化剂.
(2)写出“酸浸”中Cu2(OH)2CO3发生反应的离子方程式Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑.
(3)“中和/过滤”中加入CaCO3的目的是适当降低溶液的酸性,使Fe3+水解成沉淀而除出.
(4)流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有烧杯、玻璃棒、漏斗.
(5)加入铁屑的作用是使母液中Fe3+转化为Fe2+、除去Cu2+、提高硫酸亚铁晶体的纯度.
(6)表和图2“烘干粉碎”的试验结果.
硫酸铜晶体(CuSO4•5H2O)干燥实验表
| 序号 | t/h | t/℃ | m/g | x |
| 1 | 3 | 80 | 5 | 4 |
| 2 | 3 | 160 | 10 | 1 |
| 3 | 4 | 160 | 10 | 0.8 |
| 4 | 4 | 160 | 5 | 0 |
| 5 | 5 | 80 | 5 | 3 |
| 6 | 5 | 160 | 15 | 1 |

| A. | ①②中Mg作负极,③④中Fe作负极 | |
| B. | ②中Mg作正极,电极反应式为6H2O+6e-═6OH-+3H2↑ | |
| C. | ③中Fe作负极,电极反应式为Fe-2e-═Fe2+ | |
| D. | ④中Cu作正极,电极反应式为2Cl-+2e-=Cl2↑ |
(1)写出反应的化学方程式2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
停止加热,将试管中的混合物冷却后倒入装有冷水的烧杯中,搅拌、静置,观察到烧杯底部有黑色物质.于是他对黑色物质进行了探究.
(2)该同学假设黑色物质是CuO.检验过程如下:
【查阅文献:检验微量Cu2+的方法是:向试液中滴加K4[Fe(CN)6]溶液,若产生红褐红沉淀,证明有Cu2+】该同学的实验操作:
①将CuO放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6]溶液,产生红褐色沉淀.
②将黑色物质放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6]溶液,未见红褐色沉淀.
实验①的目的是做对比实验由该检验过程所得结论是黑色沉淀中不含CuO.
(3)再次假设,黑色物质是铜的硫化物.实验如下:
 | 现象 1A试管中黑色沉淀逐渐溶解 2A试管内上方出现浅红棕色气体 3B试管中出现白色沉淀 |
②A试管上方产生浅红棕色气体的化学方程式是2NO+O2=2NO2.
③能确认黑色沉淀中含有S元素的现象是B试管中出现白色沉淀.
(4)以上实验说明,黑色物质中存在铜的硫化物.进一步实验后证明黑色物质是CuS与Cu2S的混合物.已知1molCu2S与稀硝酸反应转移8mole-,写出试管A中Cu2S溶解的化学方程式3Cu2S+20HNO3$\frac{\underline{\;\;△\;\;}}{\;}$6Cu(NO3)2+3SO2↑+8NO↑+10H2O.