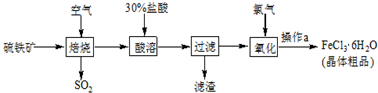
题目内容
钨是重要的战略元素,钨可以制造枪械、火箭推进器的喷嘴、切削金属,是一种用途较广的金属.工业上从经过预处理的钨矿原料(主要成分是FeWO4、MnWO4还含有Si、P、As的化合物等)制备WO4,然后通过煅烧还原三氧化钨生产钨粉.其中生产WO3的流程如下:同答下列问题: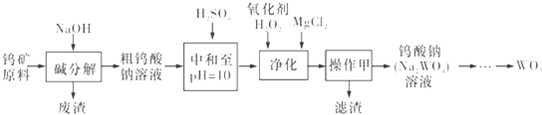
(1)上述流程中,操作甲的名称是 .
(2)pH=10的溶液中含有的杂质阴离子有SiO32-、HAsO32-、HAsO42-、HPO42-等.加入H2O2的目的是 ,其离子方程式为: .
(3)钨矿原料“碱分解”时的浸出率与原料中的CaO含量、NaOH浓度、碱用量等都有关系,如下表所示.
钨矿原料碱分解时的浸出率受NaOH浓度等因素影响的关系表
注:碱用量的单位为理论量的倍数
下列说法正确的是 .
A.增大NaOH浓度,浸出率增大
B.增大碱用量,浸出率一定增大
C.增大碱用量,浸出率一定减小
D.原料中CaO的含量增大,则浸出率增大
(4)在“净化”阶段,加入MgCl2的目的是使混合溶液中的其余酸根离子沉淀下来.此时尽量使溶液pH=10,以免产生Mg(0H)2沉淀,溶液中c(Mg2+)应不超过 {Ksp[Mg(OH)2]=5.6×10-12}.

(1)上述流程中,操作甲的名称是
(2)pH=10的溶液中含有的杂质阴离子有SiO32-、HAsO32-、HAsO42-、HPO42-等.加入H2O2的目的是
(3)钨矿原料“碱分解”时的浸出率与原料中的CaO含量、NaOH浓度、碱用量等都有关系,如下表所示.
钨矿原料碱分解时的浸出率受NaOH浓度等因素影响的关系表
| W(CaO)/% NaOH浓度/% 浸出率/% 碱用量c/(mol.L-1) | 0.1 | 1.3 | 1.3 | 2.7 |
| 30 | 30 | 40 | 40 | |
| 1.1 | 99.1 | 90.1 | 93.3 | 83.2 |
| 1.3 | 99.4 | 92.7 | 93.0 | 82.1 |
| 1.5 | 99.5 | 93.4 | 96.5 | 83.0 |
下列说法正确的是
A.增大NaOH浓度,浸出率增大
B.增大碱用量,浸出率一定增大
C.增大碱用量,浸出率一定减小
D.原料中CaO的含量增大,则浸出率增大
(4)在“净化”阶段,加入MgCl2的目的是使混合溶液中的其余酸根离子沉淀下来.此时尽量使溶液pH=10,以免产生Mg(0H)2沉淀,溶液中c(Mg2+)应不超过
考点:物质分离和提纯的方法和基本操作综合应用,化学平衡的影响因素,难溶电解质的溶解平衡及沉淀转化的本质,制备实验方案的设计
专题:实验设计题
分析:钨矿原料加入氢氧化钠溶解,得到粗钨酸钠溶液,再加硫酸调节pH=10得含有的杂质阴离子有SiO32-、HAsO32-、HAsO42-、HPO42-等的溶液,加入双氧水,将HAsO32-氧化成HAsO42-,再加氯化镁沉淀SiO32-、HAsO42-、HPO42-等,过滤所得溶液主要为钨酸钠溶液,进一步提纯得到WO4,以此分析解答;
(1)根据以上分析,操作甲的名称是过滤;
(2)根据以上分析,加入H2O2的目的是将HAsO32-氧化成HAsO42-,离子方程式为H2O2+HAsO32-═HAsO42-+H2O;
(3)根据图表数据分析;
(4)根据C(Mg2+)=
进行计算;
(1)根据以上分析,操作甲的名称是过滤;
(2)根据以上分析,加入H2O2的目的是将HAsO32-氧化成HAsO42-,离子方程式为H2O2+HAsO32-═HAsO42-+H2O;
(3)根据图表数据分析;
(4)根据C(Mg2+)=
| Ksp[Mg(OH) 2] |
| C(OH -) 2 |
解答:
解:钨矿原料加入氢氧化钠溶解,得到粗钨酸钠溶液,再加硫酸调节pH=10得含有的杂质阴离子有SiO32-、HAsO32-、HAsO42-、HPO42-等的溶液,加入双氧水,将HAsO32-氧化成HAsO42-,再加氯化镁沉淀SiO32-、HAsO42-、HPO42-等,过滤所得溶液主要为钨酸钠溶液,进一步提纯得到WO4;
(1)根据以上分析,操作甲的名称是过滤,故答案为:过滤;
(2)根据以上分析,加入H2O2的目的是将HAsO32-氧化成HAsO42-,离子方程式为H2O2+HAsO32-═HAsO42-+H2O,故答案为:氧化HAsO32-;H2O2+HAsO32-═HAsO42-+H2O;
(3)根据图表数据分析,增大NaOH浓度,浸出率增大;增大CaO浓度,浸出率减小;所以增大碱用量,浸出率不一定增大或减小,故选:A;
(4)根据C(Mg2+)=
=
=5.6×10-4mol/L,故答案为:5.6×10-4mol/L;
(1)根据以上分析,操作甲的名称是过滤,故答案为:过滤;
(2)根据以上分析,加入H2O2的目的是将HAsO32-氧化成HAsO42-,离子方程式为H2O2+HAsO32-═HAsO42-+H2O,故答案为:氧化HAsO32-;H2O2+HAsO32-═HAsO42-+H2O;
(3)根据图表数据分析,增大NaOH浓度,浸出率增大;增大CaO浓度,浸出率减小;所以增大碱用量,浸出率不一定增大或减小,故选:A;
(4)根据C(Mg2+)=
| Ksp[Mg(OH) 2] |
| C(OH -) 2 |
| 5.6×10 -12 |
| (10 -4) 2 |
点评:本题意工艺流程题为载体,综合考查学生氧化还原以及金属的冶炼等方面的知识,难度中等.

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
下列说法不正确的是( )
| A、6.02×1023就是阿伏加德罗常数 |
| B、0.012 kg 12C含有的碳原子数就是阿伏加德罗常数的值 |
| C、含有阿伏加德罗常数个粒子的物质的量是1 mol |
| D、1 mol NH3所含原子数约是2.408×1024 |
下列反应中,离子方程式正确的是( )
| A、铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| B、碳酸钙跟盐酸反应:CO32-+2H+=H2O+CO2↑ |
| C、稀硫酸跟氢氧化钾溶液反应:H++OH-═H2O |
| D、氢氧化钡溶液跟稀硫酸反应:Ba2++SO42-═BaSO4↓ |