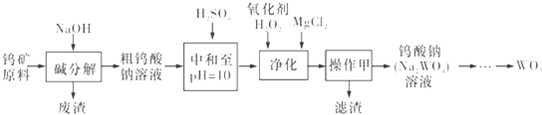
题目内容
工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:
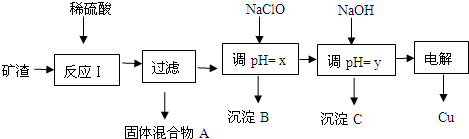
已知:Cu2O+2H+=Cu+Cu2++H2O
(1)固体混合物A中的成分是 .
(2)反应Ⅰ完成后,铁元素的存在形式为 .(填离子符号)请写出生成该离子的离子方程式 .
(3)x、y对应的数值范围分别是 、 .
(4)下列关于NaClO调pH的说法正确的是 .
a.加入NaClO可使溶液的pH降低
b.NaClO能调节pH的主要原因是由于发生反应ClO-+H+═HClO,ClO-消耗H+,从而达到调节pH的目的
c.NaClO能调节pH的主要原因是由于NaClO水解ClO-+H2O═HClO+OH-,OH-消耗H+,从而达到调节pH的目的
(5)用NaClO调pH,写出氯气制取漂白液的离子方程式: .

已知:Cu2O+2H+=Cu+Cu2++H2O
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
(2)反应Ⅰ完成后,铁元素的存在形式为
(3)x、y对应的数值范围分别是
(4)下列关于NaClO调pH的说法正确的是
a.加入NaClO可使溶液的pH降低
b.NaClO能调节pH的主要原因是由于发生反应ClO-+H+═HClO,ClO-消耗H+,从而达到调节pH的目的
c.NaClO能调节pH的主要原因是由于NaClO水解ClO-+H2O═HClO+OH-,OH-消耗H+,从而达到调节pH的目的
(5)用NaClO调pH,写出氯气制取漂白液的离子方程式:
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:矿渣加入稀硫酸氧化亚铜、氧化铝、氧化铁溶解,二氧化硅不溶所以固体混合物是不溶于稀硫酸的物质,根据反应:Cu2O+2H+=Cu+Cu2++H2O,得出A的成分是SiO2、Cu;由于单质铜存在,铁元素以Fe2+形式存在,反应方程式:2Fe3++Cu=Cu2++2Fe2+,滤液中主要是Al3+、Fe2+、Cu2+,加入NaClO具有氧化性,氧化亚铁离子为铁离子,同时调节溶液PH使铁离子、铝离子沉淀完全,根据氢氧化铁和氢氧化铝开始沉淀和沉淀结束的PH关系,x范围是:3.2≤pH<4.0,目的是沉淀氢氧化铁;y范围是:5.2≤pH<5.4,沉淀氢氧化铝;最后得到氯化铜、硫酸铜溶液,电解法获取Cu时,阴极发生还原反应:Cu2++2e-=Cu;阳极发生氧化反应:2Cl--2e-=Cl2↑;次氯酸钠中的次氯酸根结合溶液中的氢离子,PH升高;NaClO能调节pH的主要原因是由于发生反应ClO-+H+?HClO,ClO-消耗H+,从而达到调节pH的目的;溶液显示酸性,次氯酸是弱酸,次氯酸根结合酸溶液中的氢离子;生成一种具有漂白作用的物质是次氯酸.
(1)固体混合物是不溶于稀硫酸的物质,根据反应:Cu2O+2H+=Cu+Cu2++H2O,得出A的成分是SiO2、Cu;
(2)由于单质铜存在,铁元素以Fe2+形式存在,反应方程式:2Fe3++Cu=Cu2++2Fe2+;
(3)根据氢氧化铁和氢氧化铝开始沉淀和沉淀结束的PH关系,x范围是:3.2≤pH<4.0,目的是沉淀氢氧化铁;y范围是:5.2≤pH<5.4,沉淀氢氧化铝;
(4)电解法获取Cu时,阴极发生还原反应:Cu2++2e-=Cu;阳极发生氧化反应:2Cl--2e-=Cl2↑;
(5)a、次氯酸钠中的次氯酸根结合溶液中的氢离子,PH升高;
b、NaClO能调节pH的主要原因是由于发生反应ClO-+H+?HClO,ClO-消耗H+,从而达到调节pH的目的;
c、溶液显示酸性,次氯酸是弱酸,次氯酸根结合酸溶液中的氢离子;
(6)氯气与NaOH溶液反应制备漂白液.
(1)固体混合物是不溶于稀硫酸的物质,根据反应:Cu2O+2H+=Cu+Cu2++H2O,得出A的成分是SiO2、Cu;
(2)由于单质铜存在,铁元素以Fe2+形式存在,反应方程式:2Fe3++Cu=Cu2++2Fe2+;
(3)根据氢氧化铁和氢氧化铝开始沉淀和沉淀结束的PH关系,x范围是:3.2≤pH<4.0,目的是沉淀氢氧化铁;y范围是:5.2≤pH<5.4,沉淀氢氧化铝;
(4)电解法获取Cu时,阴极发生还原反应:Cu2++2e-=Cu;阳极发生氧化反应:2Cl--2e-=Cl2↑;
(5)a、次氯酸钠中的次氯酸根结合溶液中的氢离子,PH升高;
b、NaClO能调节pH的主要原因是由于发生反应ClO-+H+?HClO,ClO-消耗H+,从而达到调节pH的目的;
c、溶液显示酸性,次氯酸是弱酸,次氯酸根结合酸溶液中的氢离子;
(6)氯气与NaOH溶液反应制备漂白液.
解答:
解:(1)加入硫酸发生了反应:Cu2O+2H+=Cu+Cu2++H2O,故固体A的成分是二氧化硅和铜,故答案为:SiO2、Cu;
(2)由于发生了反应,2Fe3++Cu=Cu2++2Fe2+,溶液中铁元素的存在形式为:Fe2+,故答案为:Fe2+;2Fe3++Cu=Cu2++2Fe2+
(3)调节PH=x,目的是生成沉淀氢氧化铁,PH应该大于3.2,小于4.0;调节PH=y,生成沉淀氢氧化铝,PH需要大于5.2,小于5.4;
故答案为:3.2≤pH<4.0;5.2≤pH<5.4;
(4)电解法获取Cu时,阴极铜离子得到电子,反应为:Cu2++2e-=Cu;阳极发生氧化反应,2Cl--2e-=Cl2↑;
故答案为:Cu2++2e-=Cu;2Cl--2e-=Cl2↑
(5)a、加入NaClO可使溶液的pH会升高,因为次氯酸根消耗了溶液中的氢离子,故a错误;
b、由于NaClO能调节pH的主要原因是由于发生反应ClO-+H+?HClO,ClO-消耗H+,故b正确;
c、次氯酸钠调节溶液的PH,不是水解,是次氯酸根结合溶液中的氢离子,氢离子浓度下降,PH升高,故c错误;
故选b;
(6)氯气与NaOH溶液反应制备漂白液,则离子反应为Cl2+2OH-═Cl-+ClO-+H2O,故答案为:Cl2+2OH-═Cl-+ClO-+H2O.
(2)由于发生了反应,2Fe3++Cu=Cu2++2Fe2+,溶液中铁元素的存在形式为:Fe2+,故答案为:Fe2+;2Fe3++Cu=Cu2++2Fe2+
(3)调节PH=x,目的是生成沉淀氢氧化铁,PH应该大于3.2,小于4.0;调节PH=y,生成沉淀氢氧化铝,PH需要大于5.2,小于5.4;
故答案为:3.2≤pH<4.0;5.2≤pH<5.4;
(4)电解法获取Cu时,阴极铜离子得到电子,反应为:Cu2++2e-=Cu;阳极发生氧化反应,2Cl--2e-=Cl2↑;
故答案为:Cu2++2e-=Cu;2Cl--2e-=Cl2↑
(5)a、加入NaClO可使溶液的pH会升高,因为次氯酸根消耗了溶液中的氢离子,故a错误;
b、由于NaClO能调节pH的主要原因是由于发生反应ClO-+H+?HClO,ClO-消耗H+,故b正确;
c、次氯酸钠调节溶液的PH,不是水解,是次氯酸根结合溶液中的氢离子,氢离子浓度下降,PH升高,故c错误;
故选b;
(6)氯气与NaOH溶液反应制备漂白液,则离子反应为Cl2+2OH-═Cl-+ClO-+H2O,故答案为:Cl2+2OH-═Cl-+ClO-+H2O.
点评:本题考查了利用矿渣提取铜的操作,为高频考点,涉及的内容较多,难度中等,需要充分利用所学知识及题中信息.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子方程式,正确的是( )
| A、碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑ |
| B、Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| C、向氢氧化钡溶液中加硫酸溶液:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
| D、向NaHSO4溶液中滴加少量的Ba(OH)2溶液:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
在相同物质的量的下列分子中,电子总数最少的是( )
| A、CO |
| B、O2 |
| C、H2S |
| D、NO |
X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族,其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W,Y与Z这两对原子的最外层电子数之和均为9.下列说法不正确的是( )
| A、原子半径:Y>Z>W |
| B、XW2熔点为-107℃,沸点为12.5℃,说明固态XW2为分子晶体 |
| C、工业上电解熔融YW3可得单质Y |
| D、单质Y、Z、W均能与NaOH溶液反应 |
下列做法对人体健康无害的是( )
| A、工业酒精(含甲醇)兑水配自制白酒饮用 |
| B、用工业石蜡等给瓜子美容 |
| C、制作腊肉常加入亚硝酸盐作增色剂和防腐剂,宜长期食用 |
| D、在食用盐中加入碘酸钾(KIO3)以消除碘缺乏病 |