题目内容
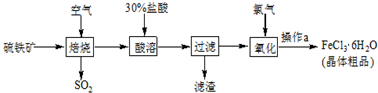
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3?6H2O)的工艺流程如下:
回答下列问题:
(1)煅烧时粉碎硫铁矿的目的是 ,该反应的化学方程式为 .
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 .
(3)操作a为 、过滤、洗涤、干燥,获得FeCl3?6H2O.
(4)焙烧产生的二氧化硫可以用来生产硫酸,其中利用催化氧化反应将SO2转化为SO3是一个关键步骤.压强及温度对SO2转化率的影响如表:
①根据表中的数据判断该反应的正向属于 (填“放热”或“吸热”)反应,理由是 .
②在400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是 ;
(5)计算每生产1万吨98%硫酸所需要含80% FeS2的 吨(假设反应过程中硫的利用率为90%,结果保留一位小数).

回答下列问题:
(1)煅烧时粉碎硫铁矿的目的是
(2)酸溶及后续过程中均需保持盐酸过量,其目的是
(3)操作a为
(4)焙烧产生的二氧化硫可以用来生产硫酸,其中利用催化氧化反应将SO2转化为SO3是一个关键步骤.压强及温度对SO2转化率的影响如表:
| 压强/KPa 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
②在400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是
(5)计算每生产1万吨98%硫酸所需要含80% FeS2的
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:根据流程,黄铁矿在高温下煅烧可以得到铁的氧化物,将其溶于盐酸中,可以得到含有亚铁离子、铁离子的盐溶液,向其中通入氯气,能将亚铁离子氧化为铁离子,氯化铁溶液蒸发浓缩、冷却结晶就可以得到氯化铁的晶体.
(1)煅烧时粉碎硫铁矿的目的是增大接触面积增大反应速率,提高原理利用率;依据流程可知反应物为FeS2和氧气,生成物为二氧化硫和铁的氧化物,据此写出反应的方程式;
(2)煅烧后生成的氧化铁与盐酸反应生成氯化铁,酸浸后生成的氯化铁是目标物质,加入过量盐酸是抑制铁离子的水解,使更多的铁元素转化为氯化铁;
(3)由溶液获得晶体需加热蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(4)①采取控制变量法,压强一定,分析温度对平衡的影响,由表中数据可知,压强一定时,温度升高时,SO2的转化率降低,说明升高温度有利于平衡向逆反应移动;
②由表中数据可知,增大压强对SO2的转化率影响不大,同时增大成本;
(5)根据S元素守恒,利用关系式计算.
(1)煅烧时粉碎硫铁矿的目的是增大接触面积增大反应速率,提高原理利用率;依据流程可知反应物为FeS2和氧气,生成物为二氧化硫和铁的氧化物,据此写出反应的方程式;
(2)煅烧后生成的氧化铁与盐酸反应生成氯化铁,酸浸后生成的氯化铁是目标物质,加入过量盐酸是抑制铁离子的水解,使更多的铁元素转化为氯化铁;
(3)由溶液获得晶体需加热蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(4)①采取控制变量法,压强一定,分析温度对平衡的影响,由表中数据可知,压强一定时,温度升高时,SO2的转化率降低,说明升高温度有利于平衡向逆反应移动;
②由表中数据可知,增大压强对SO2的转化率影响不大,同时增大成本;
(5)根据S元素守恒,利用关系式计算.
解答:
解:黄铁矿在高温下煅烧可以得到铁的氧化物,将其溶于盐酸中,可以得到含有亚铁离子、铁离子的盐溶液,向其中通入氯气,能将亚铁离子氧化为铁离子,氯化铁溶液蒸发浓缩、冷却结晶就可以得到氯化铁的晶体.
(1)煅烧时粉碎硫铁矿的目的是增大接触面积增大反应速率,提高原理利用率;依据流程可知反应物为FeS2和氧气,生成物为二氧化硫和氧化铁,反应的方程式为:4FeS2+11O2
2Fe2O3+8SO2,故答案为:增大反应物的接触面积,提高原料的利用率;4FeS2+11O2
2Fe2O3+8SO2;
(2)酸溶及后续过程中均需保持盐酸过量,其目的是使氧化铁溶解为氯化铁,抑制铁离子的水解;
故答案为:提高铁元素的浸出率;抑制Fe3+水解;
(3)由溶液获得晶体一般需要蒸发浓缩、冷却晶体、过滤、洗涤、干燥;
故答案为:蒸发浓缩、冷却结晶;
(4)①由表中数据可知,压强一定时,温度升高时,SO2的转化率降低,说明升高温度有利于平衡向逆反应移动,故正反应为放热反应,
故答案为:放热;压强一定时,温度升高,SO2转化率下降,说明升温平衡逆向移动,则正向放热;
②由表中数据可知,增大压强对SO2的转化率影响不大,同时增大成本,故通常采取采用常压而不是高压,
故答案为:在常压、400~500℃时SO2的转化率已经很高,若加压会增大对设备的要求、增大投资和能源消耗;
(5)反应的关系式为:FeS2~2SO2~2SO3~2H2SO4,
设生产1万吨98%硫酸所需要含80% FeS2质量为x,
FeS2~2SO2~2SO3~2H2SO4
120 196
x×80%×90% 1×104t×98%
x=
=8333.3t,
故答案为:8333.3.
(1)煅烧时粉碎硫铁矿的目的是增大接触面积增大反应速率,提高原理利用率;依据流程可知反应物为FeS2和氧气,生成物为二氧化硫和氧化铁,反应的方程式为:4FeS2+11O2
| ||
| ||
(2)酸溶及后续过程中均需保持盐酸过量,其目的是使氧化铁溶解为氯化铁,抑制铁离子的水解;
故答案为:提高铁元素的浸出率;抑制Fe3+水解;
(3)由溶液获得晶体一般需要蒸发浓缩、冷却晶体、过滤、洗涤、干燥;
故答案为:蒸发浓缩、冷却结晶;
(4)①由表中数据可知,压强一定时,温度升高时,SO2的转化率降低,说明升高温度有利于平衡向逆反应移动,故正反应为放热反应,
故答案为:放热;压强一定时,温度升高,SO2转化率下降,说明升温平衡逆向移动,则正向放热;
②由表中数据可知,增大压强对SO2的转化率影响不大,同时增大成本,故通常采取采用常压而不是高压,
故答案为:在常压、400~500℃时SO2的转化率已经很高,若加压会增大对设备的要求、增大投资和能源消耗;
(5)反应的关系式为:FeS2~2SO2~2SO3~2H2SO4,
设生产1万吨98%硫酸所需要含80% FeS2质量为x,
FeS2~2SO2~2SO3~2H2SO4
120 196
x×80%×90% 1×104t×98%
x=
| 120×1×104t×98% |
| 196×80%×90% |
故答案为:8333.3.
点评:本题考查了物质分离和提纯的方法,实验操作,流程分析,化学平衡的移动及有关计算,掌握物质性质和除杂原则是解题关键,计算时利用关系式可简化计算过程.

练习册系列答案
相关题目
下列反应中水作氧化剂的是( )
| A、2Na+2H2O═2NaOH+H2↑ |
| B、2F2+2H2O═4HF+O2↑ |
| C、SO2+H2O═H2SO3 |
| D、Cl2+H2O═HCl+HClO |
在物质分类中,前者包括后者的是( )
| A、氧化物、化合物 |
| B、化合物、非电解质 |
| C、溶液、胶体 |
| D、溶液、分散系 |
在相同物质的量的下列分子中,电子总数最少的是( )
| A、CO |
| B、O2 |
| C、H2S |
| D、NO |
室温下,石灰乳悬浊液存在下列平衡向Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),此悬浊液中加入少量生石灰恢复至室温,下列说法中正确的是( )
| A、n(Ca2+)增大 |
| B、c(Ca2+)减小 |
| C、pH增大 |
| D、c(OH-)不变 |