题目内容
19.对于反应3Cl2+6NaOH=5NaCl+NaClO3+3H2O,以下叙述正确的是( )| A. | Cl2是氧化剂,NaOH是还原剂 | |
| B. | 每生成1个的NaClO3转移10个的电子 | |
| C. | Cl2既是氧化剂又是还原剂 | |
| D. | 被氧化的Cl原子和被还原的Cl原子之比为5:1 |
分析 3Cl2+6NaOH=5NaCl+NaClO3+3H2O中,Cl元素的化合价由0升高为+5价,Cl元素的化合价由0降低为-1价,以此来解答.
解答 解:A.因氯气中Cl元素的化合价既升高又降低,则Cl2既是氧化剂也是还原剂,氢氧化钠中各元素的化合价都不变,所以氢氧化钠既不是氧化剂又不是还原剂,故A错误;
B.Cl元素的化合价由0升高为+5价,则每生成1个的NaClO3转移5个的电子,故B错误;
C.因氯气中Cl元素的化合价既升高又降低,则Cl2既是氧化剂也是还原剂,故C正确;
D.Cl元素的化合价由0升高为+5价,Cl元素的化合价由0降低为-1价,由电子守恒可知,被氧化的Cl原子和被还原的Cl原子的物质的量的比为1:5,故D错误.
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应中基本概念的考查,注意电子守恒的应用,题目难度不大.

练习册系列答案
相关题目
15.把铝粉和Fe3O4粉末配成铝热剂,并均分成两等份,前一份在高温下恰好完全反应,然后将生成物与足量的盐酸充分反应,第二份直接加入足量的氢氧化钠溶液使之充分反应,前后两种情况下生成气体在相同状况下的体积比为( )
| A. | 1:1 | B. | 9:8 | C. | 3:4 | D. | 4:3 |
10.已知:
①KMnO4+HCl(浓)→KCl+MnCl2+Cl2↑+H2O(未配平)
②检验Mn2+的存在:5S2O82-+2Mn2++8H2O=10SO42-+2MnO4-+16H+
下列说法中错误的是( )
①KMnO4+HCl(浓)→KCl+MnCl2+Cl2↑+H2O(未配平)
②检验Mn2+的存在:5S2O82-+2Mn2++8H2O=10SO42-+2MnO4-+16H+
下列说法中错误的是( )
| A. | S2O82-离子中存在一个过氧键(-O-O-),则S2O82-离子中硫元素的化合价为+6 | |
| B. | 反应②若有0.1mol还原剂被氧化,则转移电子0.5mol | |
| C. | K2S2O8与浓盐酸混合可得到黄绿色气体 | |
| D. | 反应①配平后还原剂与还原产物之比为8:1 |
7.区分下列各组物质,所用的两种方法不完全正确的一组是( )
| 选项 | 区分的物质 | 区分方法 |
| A | 蒸馏水和自来水 | ①蒸发 ②看颜色 |
| B | 食盐和面碱(Na2CO3) | ①加食醋 ②加石灰水 |
| C | 黄金和黄铜(假黄金) | ①灼烧 ②测密度 |
| D | 黑醋和酱油 | ①闻气味 ②尝味道 |
| A. | A | B. | B | C. | C | D. | D |
14.向一定质量的稀盐酸中加入镁粉至过量,图中横坐标表示镁粉的质量,则纵坐标表示( ) 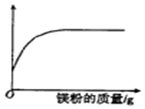

| A. | 溶液的质量 | B. | 稀盐酸的质量 | C. | 氯化镁的质量 | D. | 生成气体的质量 |
4.下列离子方程式书写不正确的是( )
| A. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时,2Al3++7OH-=Al(OH)3↓+AlO2-+2H2O | |
| B. | 向饱和Na2CO3溶液中通入过量的CO2:CO32-+CO2+H2O=2HCO3- | |
| C. | CuCl2溶液与NaHS溶液反应,当n(CuCl2):n(NaHS)=1:2时,Cu2++2HS-=CuS↓+H2S↑ | |
| D. | Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时,3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O |
11.为证明醋酸是弱电解质,下列方法不正确的是( )
| A. | 测定0.1mol•L-1醋酸溶液的pH | |
| B. | 测定0.1 mol•L-1CH3COONa溶液的酸碱性 | |
| C. | 比较浓度均为0.1 mol•L-1盐酸和醋酸溶液的导电能力 | |
| D. | 比较相同物质的量浓度的NaOH溶液和醋酸溶液恰好反应完全时消耗两溶液的体积 |
8.2.0g NaOH固体溶于水配成100mL溶液,溶液中C(Na+)为( )
| A. | 0.2 mol/L | B. | 0.3mol/L | C. | 0.4 mol/L | D. | 0.5 mol/L |