题目内容
高锰酸钾在城市生活污水处理、饮用水的净化和卫生消毒等方面应用广泛.下面是传统生产高锰酸钾的工艺流程:
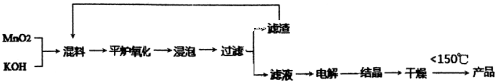
(1)下列物质能够使酸性KMnO4溶液褪色的是 (填写字母序号)
a.乙烯 b.苯 c.浓硫酸 d.硫酸亚铁溶液
(2)上述传统生产KMnO4的工艺流程中,“滤渣”可以循环利用,“滤渣”的主要成分是 (填写化学式).
(3)电解后的溶液中含有KMnO4,经过浓缩、结晶、 、 干燥,即可得到产品KMr104晶体,干燥需要控制温度低于150℃,若温度过高,则会导致 .
(4)实验室可以用KMnO4常温时氧化盐酸制备氯气:2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O
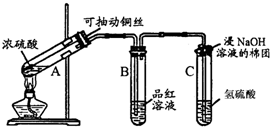
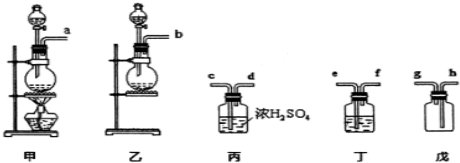
为了制备、收集干燥纯净的氯气,所需实验仪器从如下仪器中选取,按照气流的放向,各导管口的连接顺序为 → → → → → 溶液是 ,还缺少一种装置,其中发生反应的离子方程式为: .

(1)下列物质能够使酸性KMnO4溶液褪色的是
a.乙烯 b.苯 c.浓硫酸 d.硫酸亚铁溶液
(2)上述传统生产KMnO4的工艺流程中,“滤渣”可以循环利用,“滤渣”的主要成分是
(3)电解后的溶液中含有KMnO4,经过浓缩、结晶、
(4)实验室可以用KMnO4常温时氧化盐酸制备氯气:2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O
为了制备、收集干燥纯净的氯气,所需实验仪器从如下仪器中选取,按照气流的放向,各导管口的连接顺序为

考点:氯气的实验室制法
专题:实验题
分析:(1)酸性高锰酸钾溶液具有强氧化性,具有还原性或含有碳碳双键的物质能够使酸性高锰酸钾溶液褪色;
(2)根据锰酸钾、氢氧化钾易溶于水,二氧化锰不溶于水进行分析;
(3)电解后的溶液中含有KMnO4,经过浓缩、结晶会析出高锰酸钾晶体,然后通过过滤、洗涤可以得到高锰酸钾;高锰酸钾固体受热容易分解,则温度过高会导致高锰酸钾固体分解;
(4)根据该反应不需要加热可判断氯气的发生装置为乙,氯气中混有氯化氢,需要用饱和食盐水除去氯气中的氯化氢杂质,然后用浓硫酸干燥,再用集气瓶戊收集氯气;由于氯气有毒,则多余的氯气需要用氢氧化钠溶液吸收,据此进行解答.
(2)根据锰酸钾、氢氧化钾易溶于水,二氧化锰不溶于水进行分析;
(3)电解后的溶液中含有KMnO4,经过浓缩、结晶会析出高锰酸钾晶体,然后通过过滤、洗涤可以得到高锰酸钾;高锰酸钾固体受热容易分解,则温度过高会导致高锰酸钾固体分解;
(4)根据该反应不需要加热可判断氯气的发生装置为乙,氯气中混有氯化氢,需要用饱和食盐水除去氯气中的氯化氢杂质,然后用浓硫酸干燥,再用集气瓶戊收集氯气;由于氯气有毒,则多余的氯气需要用氢氧化钠溶液吸收,据此进行解答.
解答:
解:(1)a.乙烯:乙烯分子中含有碳碳双键,能够被酸性高锰酸钾溶液氧化从而导致酸性高锰酸钾溶液褪色,故a正确;
b.苯的化学性质比较稳定,不与强氧化剂发生反应,不能使酸性高锰酸钾溶液褪色,故b错误;
c.浓硫酸不与酸性高锰酸钾溶液反应,不会使酸性高锰酸钾溶液褪色,故c错误;
d.硫酸亚铁溶液中的亚铁离子具有较强还原性,能够使酸性高锰酸钾溶液褪色,故d错误;
故答案为:ad;
(2)由于反应中的二氧化锰不可能完全被氧化物锰酸钾,而氢氧化钾、锰酸钾都易溶于水,则滤渣的主要成分为MnO2,
故答案为:MnO2;
(3)电解锰酸钾得到高锰酸钾溶液溶解在水中,通过浓缩结晶析出高锰酸钾,此时过滤、洗涤可得到高锰酸钾,通过实验室用高锰酸钾制备氧气的方法可知,高锰酸钾受热易分解,故干燥温度不能太高,
故答案为:过滤、洗涤;高锰酸钾发生分解;
(4)该反应2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O不需要加热,可判断制取氯气的发生装置为乙;浓盐酸具有挥发性,制取的氯气中会混有氯化氢,需要用饱和食盐水除去氯气中的氯化氢杂质,则溶液为饱和食盐水;然后用浓硫酸干燥氯气,再用向上排空气法在集气瓶戊中收集氯气,则各导管的裂解顺序为:b→e→f→c→d→h;由于氯气有毒,多余的氯气需要用氢氧化钠溶液吸收,反应的离子方程式为:2OH-+Cl2=Cl-+ClO-+H2O,
故答案为:b;e;f;c;d;h;饱和氯化钠溶液;2OH-+Cl2=Cl-+ClO-+H2O.
b.苯的化学性质比较稳定,不与强氧化剂发生反应,不能使酸性高锰酸钾溶液褪色,故b错误;
c.浓硫酸不与酸性高锰酸钾溶液反应,不会使酸性高锰酸钾溶液褪色,故c错误;
d.硫酸亚铁溶液中的亚铁离子具有较强还原性,能够使酸性高锰酸钾溶液褪色,故d错误;
故答案为:ad;
(2)由于反应中的二氧化锰不可能完全被氧化物锰酸钾,而氢氧化钾、锰酸钾都易溶于水,则滤渣的主要成分为MnO2,
故答案为:MnO2;
(3)电解锰酸钾得到高锰酸钾溶液溶解在水中,通过浓缩结晶析出高锰酸钾,此时过滤、洗涤可得到高锰酸钾,通过实验室用高锰酸钾制备氧气的方法可知,高锰酸钾受热易分解,故干燥温度不能太高,
故答案为:过滤、洗涤;高锰酸钾发生分解;
(4)该反应2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O不需要加热,可判断制取氯气的发生装置为乙;浓盐酸具有挥发性,制取的氯气中会混有氯化氢,需要用饱和食盐水除去氯气中的氯化氢杂质,则溶液为饱和食盐水;然后用浓硫酸干燥氯气,再用向上排空气法在集气瓶戊中收集氯气,则各导管的裂解顺序为:b→e→f→c→d→h;由于氯气有毒,多余的氯气需要用氢氧化钠溶液吸收,反应的离子方程式为:2OH-+Cl2=Cl-+ClO-+H2O,
故答案为:b;e;f;c;d;h;饱和氯化钠溶液;2OH-+Cl2=Cl-+ClO-+H2O.
点评:本题考查了高锰酸钾的制备、氯气的实验室制法,题目难度中等,注意掌握氯气的实验室制法,明确高锰酸钾的制备原理为解答本题的关键,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
下列对有机物结构或性质的描述,错误的是( )
| A、乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 mol H2O |
| B、光照下2,2-二甲基丙烷与Br2蒸气反应,其一溴取代物只有一种 |
C、某有机物球棍结构模型如右图,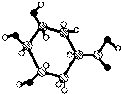 则该有机物能发生消去反应和氧化反应 则该有机物能发生消去反应和氧化反应 |
| D、二十碳五烯酸和二十二碳六烯酸是鱼油的主要成分,它们含有相同的官能团,是同系物,化学性质相似 |
下列有关同分异构体数目的叙述中,正确的是( )
| A、戊烷有2种同分异构体 |
| B、C8H10中只有三种属于芳香烃的同分异构体 |
| C、甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 |
| D、CH3CH2CH2CH3光照下与氯气反应,只生成一种一氯代烃 |
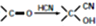
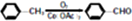
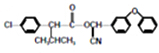 )
)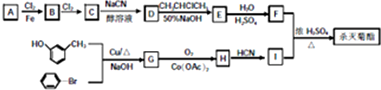
 注:合成路线的书写格式参照如下示例流程图:
注:合成路线的书写格式参照如下示例流程图:
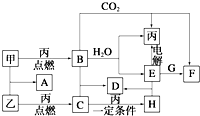 甲、乙、丙为常见单质.A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,C能使品红溶液褪色.在一定条件下,各物质相互转化关系如图所示.请回答下列问题:
甲、乙、丙为常见单质.A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,C能使品红溶液褪色.在一定条件下,各物质相互转化关系如图所示.请回答下列问题: