题目内容
水是生命之源,也是一种常用的试剂.请回答下列问题:
(1)水分子中氧原子在基态时核外电子排布式为 ;
(2)H2O分子中氧原子采取的是 杂化.
(3)水分子容易得到一个H+形成水合氢离子(H3O+).对上述过程的下列描述不合理的是 .
A.氧原子的杂化类型发生了改变
B.微粒的形状发生了改变
C.水分子仍保留它的化学性质
D.微粒中的键角发生了改变.
(1)水分子中氧原子在基态时核外电子排布式为
(2)H2O分子中氧原子采取的是
(3)水分子容易得到一个H+形成水合氢离子(H3O+).对上述过程的下列描述不合理的是
A.氧原子的杂化类型发生了改变
B.微粒的形状发生了改变
C.水分子仍保留它的化学性质
D.微粒中的键角发生了改变.
考点:原子核外电子排布,原子轨道杂化方式及杂化类型判断,不同晶体的结构微粒及微粒间作用力的区别
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)氧的原子序数是8,最外层有6个电子;
(2)根据价电子对互斥理论判断杂化方式;
(3)水中氧的杂化为sp3,H3O+中氧的杂化为sp3,据此解答;
(2)根据价电子对互斥理论判断杂化方式;
(3)水中氧的杂化为sp3,H3O+中氧的杂化为sp3,据此解答;
解答:
解:(1)氧的原子序数是8,基态时核外电子排布式为1s22s22p4,故答案为:1s22s22p4;
(2)水分子中O原子的价层电子数=2+
(6-2×1)=4,且含有2对孤电子对,所以采取SP3方式杂化,故答案为:sp3;
(3)A.水中氧的杂化为sp3,H3O+中氧的杂化为sp3,则氧原子的杂化类型没有改变,故A错误;
B.水分子为V型,H3O+为三角锥型,则微粒的形状发生了改变,故B正确;
C.因结构不同,则性质不同,微粒的化学性质发生了改变,故C正确;
D.水分子为V型,H3O+为三角锥型,微粒中的键角发生了改变,故D正确;
故答案为:A.
(2)水分子中O原子的价层电子数=2+
| 1 |
| 2 |
(3)A.水中氧的杂化为sp3,H3O+中氧的杂化为sp3,则氧原子的杂化类型没有改变,故A错误;
B.水分子为V型,H3O+为三角锥型,则微粒的形状发生了改变,故B正确;
C.因结构不同,则性质不同,微粒的化学性质发生了改变,故C正确;
D.水分子为V型,H3O+为三角锥型,微粒中的键角发生了改变,故D正确;
故答案为:A.
点评:本题考查物质结构与性质,明确原子核外电子排布规则、价层电子对理论、杂化理论即可解答,难度中等.

练习册系列答案
相关题目
下列原子各电子层中电子数不合理的是( )
| A、Sc:K(2)L(8)M(8)N(3) |
| B、Cr:K(2)L(8)M(13)N(1) |
| C、Ge:K(2)L(8)M(18)N(4) |
| D、Cu:K(2)L(8)M(18)N(1) |
P轨道电子云形状正确的是( )
| A、球形对称 |
| B、对顶对称 |
| C、极大值在x、y、z轴上的纺锤形 |
| D、互相垂直的花瓣形 |
下列叙述正确的是( )
| A、0.1mol/L NaHCO3溶液中:c(H+)+c(Na+)=c(OH-)+c(HCO3-)+c(CO32-) |
B、 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液PH随加水量的变化,则NaA溶液的PH大于同浓度的NaB溶液的PH |
C、 表示在其他条件相同时,分别在T1、T2温度下由CO2和H2合成甲醇的物质的量随时间变化情况,则CO2和H2合成甲醇是放热反应 |
D、 表示将1.000 mol/L氨水滴入20.00mL1.000 mol/L盐酸中,溶液PH和温度随加入氨水体积变化曲线 |
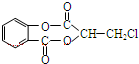 )在一定条件下可以发生如图所示的转化(其他产物和水已略去).
)在一定条件下可以发生如图所示的转化(其他产物和水已略去).
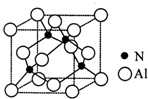 氮的化合物在无机化工领域有着重要的地位.请回答下列问题:
氮的化合物在无机化工领域有着重要的地位.请回答下列问题: ,该氧化物的化学式为
,该氧化物的化学式为 有关元素A、B、C、D的信息如下:
有关元素A、B、C、D的信息如下: