题目内容
9.下列说法正确的是( )| A. | 等质量的铝分别与足量Fe2O3或Fe3O4发生铝热反应时,转移电子的数目相等 | |
| B. | 质量分数分别为40%和60%的硫酸溶液等体积混合,所得溶液的质量分数为50% | |
| C. | 金属钠着火时,立即用泡沫灭火器灭火 | |
| D. | 洗涤做焰色反应的铂丝,可选用稀盐酸或稀硫酸 |
分析 A.根据等质量的铝失去的电子数相同判断;
B.硫酸的浓度越大,密度越大,硫酸的密度大于水的密度,将两个质量分数的硫酸等体积混合,则混合后的质量分数比原来两硫酸的质量分数的平均值要大;
C.金属钠着火生成过氧化钠,与泡沫灭火器喷出的二氧化碳反应;
D.稀硫酸可以溶解氧化物等杂质但难挥发.
解答 解:A.等质量的铝失去的电子数相同,所以等质量的铝分别与足量Fe2O3或Fe3O4发生铝热反应时,转移电子的数目相等,故A正确;
B.硫酸的密度大于水,将两个质量分数的硫酸等体积混合,则混合后的质量分数比原来两硫酸的质量分数的平均值要大,即将40%和60%的硫酸溶液等体积混合,所得溶液的质量分数大于50%,故B错误;
C.金属钠着火生成过氧化钠,与泡沫灭火器喷出的二氧化碳反应,反应生成的氧气助燃,不能灭火,应利用沙土铺盖,故C错误;
D.硫酸难挥发,清洗做焰色反应的铂丝后有残留,应该用盐酸洗涤铂丝,再灼烧至跟酒精灯火焰颜色相同后使用,去除了其它离子的干扰,且HCl受热以后易挥发,无残留,故D错误.
故选A.
点评 本题考查铝热反应转移电子数的计算、溶液混合计算、钠及其氧化物的性质以及实验等,把握物质的性质、实验基本操作等为解答的关键,题目难度不大.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
20.下列说法正确的是( )
| A. | 碘是人体必需的微量元素,所以要多吃富含高碘酸的食物 | |
| B. | 生物柴油是不同酯组成的混合物 | |
| C. | 乙酸乙酯和乙醇的混合物可以用分液的方法进行分离 | |
| D. | 工业上通过电解氯化钠溶液制备金属钠和氯气 |
17.徐光宪在《分子共和国》一书中介绍了许多明星分子,如H2O2、CO2、BF3、CH3COOH等.下列说法正确的是( )
| A. | H2O2分子的空间构型为直线形 | |
| B. | CO2分子为含有极性键的极性分子 | |
| C. | BF3分子中的B原子不满足8电子稳定结构 | |
| D. | CH3COOH分子中C原子均为sp2杂化 |
4.化学与社会、生活密切相关,对下列现象或亊实的解释不正确的是( )
| 选项 | 现象或事实 | 解释 |
| A. | 肉制品中添加适量的亚硝酸钠 | 亚硝酸钠有防腐的作用 |
| B. | 液氨常用作制冷剂 | 液氨汽化时要吸收大量的热 |
| C. | 利用静电除尘装置除去粉尘 | 胶体粒子带电 |
| D. | Al(OH)3用作塑料的阻燃剂 | Al(OH)3受热熔化吸收大量的热 |
| A. | A | B. | B | C. | C | D. | D |
14.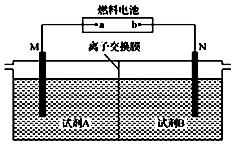 以二甲醚(CH3OCH3)酸性燃料电池为电源,电解饱和食盐水制备氯气和烧碱,设计装置如图所示.已知:a电扱的反应式为O2+4H++4e-═2H2O,下列说法不正确的是( )
以二甲醚(CH3OCH3)酸性燃料电池为电源,电解饱和食盐水制备氯气和烧碱,设计装置如图所示.已知:a电扱的反应式为O2+4H++4e-═2H2O,下列说法不正确的是( )
 以二甲醚(CH3OCH3)酸性燃料电池为电源,电解饱和食盐水制备氯气和烧碱,设计装置如图所示.已知:a电扱的反应式为O2+4H++4e-═2H2O,下列说法不正确的是( )
以二甲醚(CH3OCH3)酸性燃料电池为电源,电解饱和食盐水制备氯气和烧碱,设计装置如图所示.已知:a电扱的反应式为O2+4H++4e-═2H2O,下列说法不正确的是( )| A. | b电极的反应式为CH3OCH3+3H2O-12e-═2CO2↑+12H+ | |
| B. | 试剂A为饱和食盐水,试刑B为NaOH稀溶液 | |
| C. | 阳极生成1 mol气体时,有1mol离子通过离子交换膜 | |
| D. | 阴极生成1 mol气体时,理论上导线中流过2 mol e- |
1.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 室温下,1LpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | |
| B. | 0.1mol${\;}_{38}^{90}$Sr原子中含中子数为3.8NA | |
| C. | 足量的O2与1molNa充分反应,转移的电子数为NA | |
| D. | 50mL12mol•L-1的盐酸与足量MnO2共热,转移电子数为0.3NA |
18.短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的.由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生.下列说法不正确的是( )
| A. | X的简单氢化物的热稳定性比W强 | |
| B. | Y的简单离子与X的具有相同的电子层结构 | |
| C. | Y与Z形成的化合物的水溶液可使蓝色石蕊试纸变红 | |
| D. | Z与X属于同一主族,与Y属于同一周期 |
 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,其工作原理如图所示.电池总反应是:Mg+H2O2+2H+═Mg2++2H2O
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,其工作原理如图所示.电池总反应是:Mg+H2O2+2H+═Mg2++2H2O 研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景.回答下列问题:
研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景.回答下列问题: