题目内容
13. 全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8).下列说法错误的是( )
全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8).下列说法错误的是( )| A. | 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4 | |
| B. | 电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g | |
| C. | 石墨烯的作用主要是提高电极a的导电性 | |
| D. | 电池充电时间越长,电池中的Li2S2量越多 |
分析 由电池反应16Li+xS8=8Li2Sx(2≤x≤8)可知负极锂失电子发生氧化反应,电极反应为:Li-e-=Li+,Li+移向正极,所以a是正极,发生还原反应:S8+2e-=S82-,S82-+2Li+=Li2S8,3Li2S8+2Li++2e-=4Li2S6,2Li2S6+2Li++2e-=3Li2S4,Li2S4+2Li++2e-=2Li2S2,根据电极反应式结合电子转移进行计算.
解答 解:A.据分析可知正极可发生反应:2Li2S6+2Li++2e-=3Li2S4,故A正确;
B.负极反应为:Li-e-=Li+,当外电路流过0.02mol电子时,消耗的锂为0.02mol,负极减重的质量为0.02mol×7g/mol=0.14g,故B正确;
C.硫作为不导电的物质,导电性非常差,而石墨烯的特性是室温下导电最好的材料,则石墨烯的作用主要是提高电极a的导电性,故C正确;
D.充电时a为阳极,与放电时的电极反应相反,则充电时间越长,电池中的Li2S2量就会越少,故D错误;
故选D.
点评 本题考查新型电池,注意把握原电池的工作原理以及电极反应式的书写,解答本题的关键是根据离子的流向判断原电池的正负极,题目难度中等.

练习册系列答案
相关题目
4.化学与社会、生活密切相关,对下列现象或亊实的解释不正确的是( )
| 选项 | 现象或事实 | 解释 |
| A. | 肉制品中添加适量的亚硝酸钠 | 亚硝酸钠有防腐的作用 |
| B. | 液氨常用作制冷剂 | 液氨汽化时要吸收大量的热 |
| C. | 利用静电除尘装置除去粉尘 | 胶体粒子带电 |
| D. | Al(OH)3用作塑料的阻燃剂 | Al(OH)3受热熔化吸收大量的热 |
| A. | A | B. | B | C. | C | D. | D |
1.Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示.由图可知,当铁的浸出率为70%时,所采用的实验条件为100℃、2h或90℃、5h.

(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O.
(3)TiO2•xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
分析40℃时TiO2•xH2O转化率最高的原因温度高反应速率加快,但温度过高过氧化氢分解、氨水易挥发,影响转化率.
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为4.
(5)若“滤液②”中c(Mg2+)=0.02mol•L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5,此时是否有Mg3(PO4)2沉淀生成?c(PO43-)=$\frac{1.3×1{0}^{22}}{1×1{0}^{-5}}$=1.0×10-17mol/L,Qc[Mg3(PO4)2]=($\frac{0.02mol/L}{2}$)3×(1.0×10-17mol/L)2=1.69×10-40<Ksp=1.0×10-24,则无沉淀生成(列式计算).FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式2FePO4+Li2CO3+H2C2O4$\frac{\underline{\;高温\;}}{\;}$2LiFePO4+H2O+3CO2↑.

回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示.由图可知,当铁的浸出率为70%时,所采用的实验条件为100℃、2h或90℃、5h.

(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O.
(3)TiO2•xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
| 温度/℃ | 30 | 35 | 40 | 45 | 50 |
| TiO2•xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为4.
(5)若“滤液②”中c(Mg2+)=0.02mol•L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5,此时是否有Mg3(PO4)2沉淀生成?c(PO43-)=$\frac{1.3×1{0}^{22}}{1×1{0}^{-5}}$=1.0×10-17mol/L,Qc[Mg3(PO4)2]=($\frac{0.02mol/L}{2}$)3×(1.0×10-17mol/L)2=1.69×10-40<Ksp=1.0×10-24,则无沉淀生成(列式计算).FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式2FePO4+Li2CO3+H2C2O4$\frac{\underline{\;高温\;}}{\;}$2LiFePO4+H2O+3CO2↑.
8.下述实验中均有红棕色气体产生,对比分析所的结论不正确的是( )
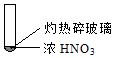 | 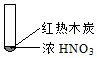 | 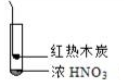 |
| ① | ② | ③ |
| A. | 由①中的红棕色气体,推断产生的气体一定是混合气体 | |
| B. | 红棕色气体不能表明②中木炭与浓硝酸产生了反应 | |
| C. | 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物 | |
| D. | ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应 |
5.常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)?Ni(CO)4(g).230℃时,该反应的平衡常数K=2×10-5.已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应.
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍.
下列判断正确的是( )
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍.
下列判断正确的是( )
| A. | 增加c(CO),平衡向正向移动,反应的平衡常数增大 | |
| B. | 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃ | |
| C. | 第二阶段,Ni(CO)4分解率较低 | |
| D. | 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO) |
8.下列说法正确的是( )
| A. | 反应N2 (g)+3H2 (g)?2NH3 (g)的△H<0,△S>0 | |
| B. | 地下钢铁管道用导线连接锌块可以减缓管道的腐蚀 | |
| C. | 常温下,Ksp[Mg(OH)2]=5.6×10-12,pH=10的含Mg2+溶液中,c(Mg2+ )≤5.6×10-4 mol•L-1 | |
| D. | 常温常压下,锌与稀H2SO4反应生成11.2 L H2,反应中转移的电子数为6.02×1023 |
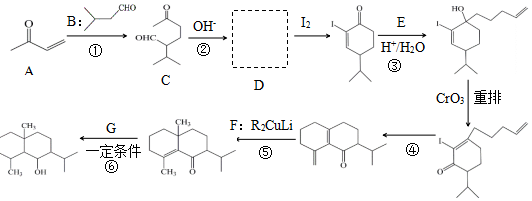
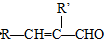 +H2O
+H2O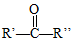 →
→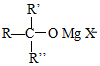 $\stackrel{H+/H_{2}O}{→}$
$\stackrel{H+/H_{2}O}{→}$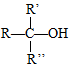

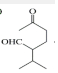 $\stackrel{O{H}^{-}}{→}$
$\stackrel{O{H}^{-}}{→}$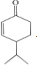 +H2O.
+H2O.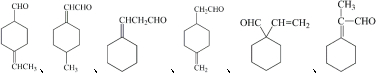
 研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景.回答下列问题:
研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景.回答下列问题:

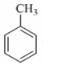 分子中不同化学环境的氢原子共有4种,共面原子数目最多为13.
分子中不同化学环境的氢原子共有4种,共面原子数目最多为13.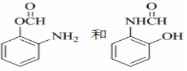 .
. ,该步反应的主要目的是保护氨基.
,该步反应的主要目的是保护氨基. 为主要原料,经最少步骤制备含肽键聚合物的流程.
为主要原料,经最少步骤制备含肽键聚合物的流程.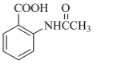 …$→_{反应条件}^{反应试剂}$目标化合物
…$→_{反应条件}^{反应试剂}$目标化合物