题目内容
11.室温下,现有四组混合溶液:A.0.1mol•L-1 NaHCO3溶液与0.1mol•L-1 NaOH溶液等体积混合
B.20mL 0.1mol•L-1 CH3COONa溶液与10mL 0.1mol•L-1 HCl溶液混合
C.pH=2的盐酸溶液与pH=12的氨水等体积混合
D.0.1mol•L-1 CH3COOH溶液与0.1mol•L-1 NaOH溶液等体积混合
(1)请写出各溶液混合时发生反反应的离子方程式;
(2)判断各混合溶液的溶质成分及物质的量浓度,并比较四种混合溶液的酸碱性强弱;
(3)写出A溶液的电荷守恒、物料守恒、质子守恒等式.
分析 (1)A.0.1mol•L-1 NaHCO3溶液与0.1mol•L-1 NaOH溶液等体积混合反应生成碳酸钠和水;
B.20mL 0.1mol•L-1 CH3COONa溶液与10mL 0.1mol•L-1 HCl溶液混合反应生成醋酸和氯化钠,醋酸钠过量,最后得到醋酸钠和醋酸、氯化钠的混合溶液;
C.pH=2的盐酸溶液与pH=12的氨水等体积混合,一水合氨是弱电解质;
D.0.1mol•L-1 CH3COOH溶液与0.1mol•L-1 NaOH溶液等体积混合生成醋酸钠溶液;
(2)A.0.1mol•L-1 NaHCO3溶液与0.1mol•L-1 NaOH溶液等体积混合反应生成碳酸钠和水,碳酸氢钠水解溶液显碱性;
B.20mL 0.1mol•L-1 CH3COONa溶液与10mL 0.1mol•L-1 HCl溶液混合反应生成醋酸和氯化钠,醋酸钠过量,最后得到醋酸钠和醋酸、氯化钠的混合溶液,醋酸电离大于醋酸根离子水解溶液显酸性;
C.pH=2的盐酸溶液与pH=12的氨水等体积混合,一水合氨是弱电解质,反应后一水合氨又电离溶液显碱性;
D.0.1mol•L-1 CH3COOH溶液与0.1mol•L-1 NaOH溶液等体积混合生成醋酸钠溶液,醋酸根离子水解溶液显碱性;
(3)0.1mol•L-1 NaHCO3溶液与0.1mol•L-1 NaOH溶液等体积混合反应生成碳酸钠和水,碳酸钠溶液中电荷守恒是溶液中阴阳离子所带电荷总数相同,物料守恒是n(Na)=2n(C),质子守恒是水电离出氢氧根离子浓度等于所有氢离子存在形式总和;
解答 解:(1)A.0.1mol•L-1 NaHCO3溶液与0.1mol•L-1 NaOH溶液等体积混合反应生成碳酸钠和水,反应的化学方程式为:NaHCO3+NaOH=Na2CO3+H2O;
B.20mL 0.1mol•L-1 CH3COONa溶液与10mL 0.1mol•L-1 HCl溶液混合反应生成醋酸和氯化钠,醋酸钠过量,最后得到醋酸钠和醋酸、氯化钠的混合溶液,反应的化学方程式为:CH3COONa+HCl=NaCl+CH3COOH;
C.pH=2的盐酸溶液与pH=12的氨水等体积混合,一水合氨是弱电解质,NH3•H2O+HCl=NH4Cl+H2O;
D.0.1mol•L-1 CH3COOH溶液与0.1mol•L-1 NaOH溶液等体积混合生成醋酸钠溶液,反应的化学方程式为CH3COOH+NaOH=CH3COONa+H2O;
答:A中化学方程式为:NaHCO3+NaOH=Na2CO3+H2O,B中化学方程式为:CH3COONa+HCl=NaCl+CH3COOH,C中 化学方程式为:NH3•H2O+HCl=NH4Cl+H2O,D中化学方程式为:CH3COOH+NaOH=CH3COONa+H2O;
(2)A.0.1mol•L-1 NaHCO3溶液与0.1mol•L-1 NaOH溶液等体积混合反应生成碳酸钠和水,NaHCO3+NaOH=Na2CO3+H2O,碳酸钠溶液浓度0.05mol/L,碳酸氢钠水解溶液显碱性;
B.20mL 0.1mol•L-1 CH3COONa溶液与10mL 0.1mol•L-1 HCl溶液混合反应生成醋酸和氯化钠,醋酸钠过量,CH3COONa+HCl=NaCl+CH3COOH,最后得到醋酸钠和醋酸、氯化钠的混合溶液,溶液中醋酸钠、醋酸、氯化钠浓度都为$\frac{0.1}{3}$mol/L,醋酸电离大于醋酸根离子水解溶液显酸性;
C.pH=2的盐酸溶液与pH=12的氨水等体积混合,发生反应NH3•H2O+HCl=NH4Cl+H2O,一水合氨是弱电解质,反应后一水合氨又电离溶液显碱性,得到溶液中含溶质为:NH4Cl和NH3•H2O,氯化铵浓度为0.005mol/L,一水合氨浓度小于0.005mol/L;
D.0.1mol•L-1 CH3COOH溶液与0.1mol•L-1 NaOH溶液等体积混合生成醋酸钠溶液,CH3COOH+NaOH=CH3COONa+H2O,生成醋酸钠溶液浓度为0.05mol/L,醋酸根离子水解溶液显碱性,
答:A中溶质为Na2CO3,溶液浓度0.05mol/L;B中溶质为CH3COONa、CH3COOH、NaCl,浓度都为$\frac{0.1}{3}$mol/L;C中溶质NH4Cl和NH3•H2O;D中溶质为CH3COONa,浓度为0.05mol/L;
(3)0.1mol•L-1 NaHCO3溶液与0.1mol•L-1 NaOH溶液等体积混合反应生成碳酸钠和水,碳酸钠溶液中电荷守恒是溶液中阴阳离子所带电荷总数相同,c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-),物料守恒是n(Na)=2n(C),c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),质子守恒是水电离出氢氧根离子浓度等于所有氢离子存在形式总和,c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+),
答:c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-),c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+);
点评 本题考查了酸碱反应后溶液中溶质成分,溶液酸碱性判断,电解质溶液中盐类水解应用,注意电解质溶液中电荷守恒、物料守恒和质子守恒的判断,题目难度中等.

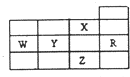
| A. | P亚层未成对电子最多的是Z元素 | |
| B. | Y、Z的阴离子电子层结构都与R原子的相同 | |
| C. | W元素的第一电离能小于Y元素的第一电离能 | |
| D. | X元素是电负性最大的元素 |
| A. | 用食醋除去水壶中的水垢 | B. | 氯气泄漏后应顺风向低处跑 | ||
| C. | 用铝锅炒菜比用铁锅好 | D. | 食用“加碘”食盐不利于健康 |
| A. | Na2CO3、NaHCO3、NaCl、HCl | B. | Na2CO3、NaHCO3、HCl、NaCl | ||
| C. | (NH4)2SO4、NH4Cl、NaNO3、Na2CO3 | D. | NH4Cl、(NH4)2SO4、Na2CO3、NaNO3 |
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 过滤时,应用玻璃棒搅拌漏斗中的待过滤液体 | |
| D. | 称量时,称量物放在称量纸(或称量器皿)上,置于托盘天平的左盘;砝码放在托盘天平的右盘中 |
| A. | $\frac{6A%}{7}$ | B. | $\frac{(1-A%)}{7}$ | C. | $\frac{6(1-A%)}{7}$ | D. | (100-$\frac{7A}{6}$)% |
| A. | 豆浆中加入CaSO4制豆腐 | |
| B. | 清晨在茂密的森林里看到缕缕阳光穿过林木枝叶 | |
| C. | FeCl3溶液中加入NaOH溶液产生红褐色沉淀 | |
| D. | 使用钢笔时不宜将不同品牌的墨水混用 |
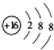
 ; (2)铝离子的结构示意图:
; (2)铝离子的结构示意图: ;
;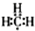
 ; (6)NH4Cl的电子式:
; (6)NH4Cl的电子式: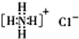 ;
;