题目内容
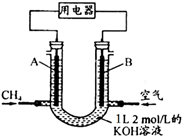 将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.
将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.(1)0<V≤22.4L时,电池总反应的化学方程式为
(2)22.4L<V≤44.8L时,负极电极反应为
(3)V=33.6L时,溶液中阴离子浓度大小关系为
考点:原电池和电解池的工作原理,离子浓度大小的比较
专题:
分析:(1)n(KOH)=2mol/L×1L=2mol,该装置是燃料电池,负极上甲烷失电子发生氧化反应,正极上氧气得电子发生还原反应,根据原子守恒得0<n(CO2)≤1mol,二氧化碳不足量,则二者反应生成碳酸钾;
(2)根据原子守恒得1<n(CO2)≤2mol,二者反应生成碳酸氢钾;
(3)当V=33.6L时,n(CO2)=1.5mol,设碳酸钾的物质的量为x、碳酸氢钾的物质的量为y,根据K原子、C原子守恒得
,解得
,碳酸根离子水解程度大于碳酸氢根离子,据此计算离子浓度大小.
(2)根据原子守恒得1<n(CO2)≤2mol,二者反应生成碳酸氢钾;
(3)当V=33.6L时,n(CO2)=1.5mol,设碳酸钾的物质的量为x、碳酸氢钾的物质的量为y,根据K原子、C原子守恒得
|
|
解答:
解:(1)n(KOH)=2mol/L×1L=2mol,该装置是燃料电池,负极上甲烷失电子发生氧化反应,正极上氧气得电子发生还原反应,根据原子守恒得0<n(CO2)≤1mol,二氧化碳不足量,则二者反应生成碳酸钾,电池反应式为CH4+2O2+2KOH=K2CO3+3H2O,故答案为:CH4+2O2+2KOH=K2CO3+3H2O;
(2)根据原子守恒得1<n(CO2)≤2mol,二者反应生成碳酸氢钾,所以负极反应式为CH4-8e-+9CO32-+3H2O=10HCO3-,故答案为:CH4-8e-+9CO32-+3H2O=10HCO3-;
(3)当V=33.6L时,n(CO2)=1.5mol,设碳酸钾的物质的量为x、碳酸氢钾的物质的量为y,根据K原子、C原子守恒得
,解得
,碳酸根离子水解程度大于碳酸氢根离子,但水解程度较小,所以溶液中离子浓度大小顺序为c(HCO3-)>c(CO32-)>c(OH-),故答案为:c(HCO3-)>c(CO32-)>c(OH-).
(2)根据原子守恒得1<n(CO2)≤2mol,二者反应生成碳酸氢钾,所以负极反应式为CH4-8e-+9CO32-+3H2O=10HCO3-,故答案为:CH4-8e-+9CO32-+3H2O=10HCO3-;
(3)当V=33.6L时,n(CO2)=1.5mol,设碳酸钾的物质的量为x、碳酸氢钾的物质的量为y,根据K原子、C原子守恒得
|
|
点评:本题以原电池原理为载体考查物质之间的反应,明确二氧化碳和KOH反应产物是解本题关键,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,题目难度中等.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案
相关题目
当电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是( )
| A、当电池负极消耗m g气体时,电解池阳极同时有m g气体生成 |
| B、电解后c(Na2CO3)不变,且溶液中有晶体析出 |
| C、电池的负极反应式为:O2+2H2O+4e-═4OH- |
| D、电池中c(KOH)不变 |
下列有关实验室制取气体的反应中,其原理不属于氧化还原反应的是( )
| A、实验室中用稀硫酸与锌粒反应制取H2 |
| B、实验室中用高锰酸钾加热分解制取O2 |
| C、实验室中用H2O2与MnO2作用产生O2 |
| D、实验室中用稀盐酸与石灰石反应制取CO2 |
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构与双氧水分子相似.常温下,S2Cl2是一种橙黄色液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )
| A、S2Cl2的结构式为Cl-S-S-Cl |
| B、S2Cl2为含有极性键和非极性键的极性分子 |
| C、S2Br2与S2Cl2结构相似,熔沸点S2Cl2>S2Br2 |
| D、2S2Cl2+2H2O=SO2↑+3S↓+4HCl |