题目内容
当电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是( )
| A、当电池负极消耗m g气体时,电解池阳极同时有m g气体生成 |
| B、电解后c(Na2CO3)不变,且溶液中有晶体析出 |
| C、电池的负极反应式为:O2+2H2O+4e-═4OH- |
| D、电池中c(KOH)不变 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:该燃料电池为碱性电池,电池的正极反应为:O2+2H20+4e-═4OH-,负极反应为H2-2e-+2OH-═H2O,电解饱和碳酸钠溶液阴极发生的反应为:2H++2e-═H2↑,阳极反应为:4OH--4e-═O2↑+2H20,以此回答各电极的变化.
解答:
解:A、电池负极反应为:H2-2e-+2OH-═H2O,当负极消耗mg气体时,转移的电子的物质的量为
mol×2=mmol,电解池阳极得电子为 m mol,阳极发生的反应为:4OH--4e-═O2↑+2H20,阳极生成气体的质量为
mol×32g/mol=8mg,故A错误;
B、电解后,由于电解了水,水的质量减小,碳酸钠为饱和溶液,所以会析出碳酸钠晶体,但是c(Na2CO3)不变,故B正确;
C、该燃料电池为碱性电池,电池的正极反应为:O2+2H20+4e-═4OH-,故C错误;
D、燃料电池的总反应为O2+2H2═2H20,溶质的物质的量不变,但溶液的体积增大,所以原电池中c(KOH)减小,故D错误;
故选:B.
| m |
| 2 |
| m |
| 4 |
B、电解后,由于电解了水,水的质量减小,碳酸钠为饱和溶液,所以会析出碳酸钠晶体,但是c(Na2CO3)不变,故B正确;
C、该燃料电池为碱性电池,电池的正极反应为:O2+2H20+4e-═4OH-,故C错误;
D、燃料电池的总反应为O2+2H2═2H20,溶质的物质的量不变,但溶液的体积增大,所以原电池中c(KOH)减小,故D错误;
故选:B.
点评:本题考查了原电池和电解池原理,注意把握原电池和电解池中电极方程式的书写方法,注意电子守恒在计算中的应用,题目难度中等.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
下列标明电子转移的方向和数目的化学方程式中正确的是( )
A、 |
B、 |
C、 |
D、 |
某元素基态原子的外围电子排布为3d54s2,则下列说法不正确的是( )
| A、该元素为Mn元素 |
| B、该元素原子核外有4个能层 |
| C、该元素原子最外层共有7个电子 |
| D、该元素属于d区元素 |
能正确表示下列反应的离子方程式是( )
| A、Na2O2加入水制备O2:2O22-+2H2O=4OH-+O2↑ |
| B、用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
| C、向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| D、向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
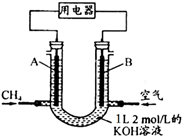 将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.
将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.