题目内容
已知:Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,能氧化浓盐酸生成C12;
(1)写出Pb3O4与浓盐酸反应的化学方程式 .
(2)PbO2不稳定,随温度升高按下列顺序逐步分解:PbO2→Pb2O3→Pb3O4→PbO.若加热分解后所得到的固体全部为Pb3O4,现将a mol PbO2加热分解,则加热过程中放出O2 L(标准状况下);
(3)现将1mol PbO2加热分解,收集产生的O2,加热分解后所得固体中,pb2+占Pb元素的物质的量分数为x;再向加热所得固体中加入足量的浓盐酸,收集产生的C12,收集到O2和C12的物质的量之和为y mol.试回答下列问题:
①通过计算确定y与x的函数关系式.
②若两步反应中O2和Cl2的物质的量之比为3:5,则剩余固体中含有的物质为 ,其物质的量之比为 .
(1)写出Pb3O4与浓盐酸反应的化学方程式
(2)PbO2不稳定,随温度升高按下列顺序逐步分解:PbO2→Pb2O3→Pb3O4→PbO.若加热分解后所得到的固体全部为Pb3O4,现将a mol PbO2加热分解,则加热过程中放出O2
(3)现将1mol PbO2加热分解,收集产生的O2,加热分解后所得固体中,pb2+占Pb元素的物质的量分数为x;再向加热所得固体中加入足量的浓盐酸,收集产生的C12,收集到O2和C12的物质的量之和为y mol.试回答下列问题:
①通过计算确定y与x的函数关系式.
②若两步反应中O2和Cl2的物质的量之比为3:5,则剩余固体中含有的物质为
考点:氧化还原反应的计算
专题:
分析:(1)Pb3O4中+4价的Pb具有强氧化性,能氧化浓盐酸,+4价的Pb被浓盐酸还原成+2价,确定生成物PbC12、C12、H2O;
(2)根据题意,确定反应物为PbO2,生成物为Pb3O4和O2,结合方程式计算;
(3)根据氧化还原反应的本质电子得失守恒求出n(O2)、n(Cl2),即得y与x的函数关系.根据两步反应中O2和Cl2的物质的量之比为3:5,求出x的值,确定出
n(pb2+):n(pb4+)的比值.
(2)根据题意,确定反应物为PbO2,生成物为Pb3O4和O2,结合方程式计算;
(3)根据氧化还原反应的本质电子得失守恒求出n(O2)、n(Cl2),即得y与x的函数关系.根据两步反应中O2和Cl2的物质的量之比为3:5,求出x的值,确定出
n(pb2+):n(pb4+)的比值.
解答:
解:(1)Pb3O4中Pb的化合价只有+2、+4,再根据化合价代数和等于零,求得Pb的总化合价为+8价,即可确定Pb3O4中有一个+4价、有两个+2价,且+4价的Pb具有强氧化性,能氧化浓盐酸生成C12,本身被还原成+2价Pb,生成PbC12,
Pb3O4中一个+4价的Pb降低到+2价,降低2价;HCl(浓)中-1价的Cl上升到0价生成Cl2,上升1价×2,所以Pb3O4和Cl2前面的计量数都为1,根据原子守恒配平其它物质前计量数,得方程式为Pb3O4+8HCl(浓)═3PbCl2+Cl2↑+4H2O,
故答案为:Pb3O4+8HCl(浓)═3PbCl2+Cl2↑+4H2O;
(2)根据题意,确定反应物为PbO2,生成物为Pb3O4和O2,因此方程式为 3PbO2
Pb3O4+O2,
设生成氧气物质的量为x,
3PbO2
Pb3O4+O2
3mol 1mol
amol x
解得:x═
mol
则V(O2)═
mol×22.4L/mol═
L,
故答案为:
;
(3)①根据题意:1mol PbO2分解所得混合物中n(Pb2+)=x mol、n(Pb4+)=(1-x) mol.在反应过程中1mol PbO2中+4价的Pb具有强氧化性作氧化剂,
+4价的Pb最终全部降低为+2价,
根据得失电子守恒:先加热分解生成O2,得n(O2)=
=
mol;
后再与足量的浓盐酸反应生成Cl2,得n(Cl2)=
=(1-x) mol,
则 y=n(O2)+n(Cl2)=
mol+(1-x) mol=(1-
)mol,
故答案为:y=(1-
)mol;
②若两步反应中O2和Cl2的物质的量之比为3:5,
根据上述分析:n(O2)=
=
mol,n(Cl2)=
=(1-x) mol,
即
:(1-x)=3:5,
解得:x=
,
则剩余固体中含pb2+的物质的量分数为
,含pb4+的物质的量分数为
,即n(pb2+):n(pb4+)═6:5,
由题意,PbO2不稳定逐步分解顺序:PbO2→Pb2O3→Pb3O4→PbO.因为Pb的化合价只有+2、+4,所以Pb2O3可表示为
PbO?PbO2,Pb3O4可表示为2PbO?PbO2,各氧化物中n(pb2+):n(pb4+)的比值关系为:
PbO2中,n(pb2+):n(pb4+)═0:1
Pb2O3中,n(pb2+):n(pb4+)═1:1
Pb3O4中,n(pb2+):n(pb4+)═2:1
PbO中,n(pb2+):n(pb4+)═1:0
根据剩余固体中n(pb2+):n(pb4+)═6:5,介于1:1和2:1之间,可推出剩余固体中所含物质为Pb2O3、Pb3O4.
设剩余固体中Pb2O3物质的量为a、Pb3O4物质的量为b,
得n(pb2+)═a+2b,n(pb4+)═a+b,
则(a+2b):(a+b)═6:5
解得a:b═4:1,即(Pb2O3):(Pb3O4)═4:1,
故答案为:Pb2O3、Pb3O4;4:1.
Pb3O4中一个+4价的Pb降低到+2价,降低2价;HCl(浓)中-1价的Cl上升到0价生成Cl2,上升1价×2,所以Pb3O4和Cl2前面的计量数都为1,根据原子守恒配平其它物质前计量数,得方程式为Pb3O4+8HCl(浓)═3PbCl2+Cl2↑+4H2O,
故答案为:Pb3O4+8HCl(浓)═3PbCl2+Cl2↑+4H2O;
(2)根据题意,确定反应物为PbO2,生成物为Pb3O4和O2,因此方程式为 3PbO2
| ||
设生成氧气物质的量为x,
3PbO2
| ||
3mol 1mol
amol x
解得:x═
| a |
| 3 |
则V(O2)═
| a |
| 3 |
| 22.4a |
| 3 |
故答案为:
| 22.4a |
| 3 |
(3)①根据题意:1mol PbO2分解所得混合物中n(Pb2+)=x mol、n(Pb4+)=(1-x) mol.在反应过程中1mol PbO2中+4价的Pb具有强氧化性作氧化剂,
+4价的Pb最终全部降低为+2价,
根据得失电子守恒:先加热分解生成O2,得n(O2)=
| 2xmol |
| 4 |
| x |
| 2 |
后再与足量的浓盐酸反应生成Cl2,得n(Cl2)=
| (1-x)mol×2 |
| 2 |
则 y=n(O2)+n(Cl2)=
| x |
| 2 |
| x |
| 2 |
故答案为:y=(1-
| x |
| 2 |
②若两步反应中O2和Cl2的物质的量之比为3:5,
根据上述分析:n(O2)=
| 2xmol |
| 4 |
| x |
| 2 |
| (1-x)mol×2 |
| 2 |
即
| x |
| 2 |
解得:x=
| 6 |
| 11 |
则剩余固体中含pb2+的物质的量分数为
| 6 |
| 11 |
| 5 |
| 11 |
由题意,PbO2不稳定逐步分解顺序:PbO2→Pb2O3→Pb3O4→PbO.因为Pb的化合价只有+2、+4,所以Pb2O3可表示为
PbO?PbO2,Pb3O4可表示为2PbO?PbO2,各氧化物中n(pb2+):n(pb4+)的比值关系为:
PbO2中,n(pb2+):n(pb4+)═0:1
Pb2O3中,n(pb2+):n(pb4+)═1:1
Pb3O4中,n(pb2+):n(pb4+)═2:1
PbO中,n(pb2+):n(pb4+)═1:0
根据剩余固体中n(pb2+):n(pb4+)═6:5,介于1:1和2:1之间,可推出剩余固体中所含物质为Pb2O3、Pb3O4.
设剩余固体中Pb2O3物质的量为a、Pb3O4物质的量为b,
得n(pb2+)═a+2b,n(pb4+)═a+b,
则(a+2b):(a+b)═6:5
解得a:b═4:1,即(Pb2O3):(Pb3O4)═4:1,
故答案为:Pb2O3、Pb3O4;4:1.
点评:本题考查氧化还原反应知识,为高频考点,侧重于学生的分析能力和计算能力的考查,利用化合价升降法配平,抓住本质电子的得失守恒是解题的关键,同时结合中间值确定反应产物.该题对抽象思维能力要求较高,难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
一定条件下,向0.1mol?L-1 CH3COONa溶液中滴加CH3COOH溶液至混合溶液中离子浓度满足如下关系:c(Na+)+c(OH-)=c(H+)+c(CH3COO-),则混合溶液中下列关系正确的是( )
| A、c(OH-)>c(H+) |
| B、c(CH3COO-)=0.1 mol?L-1 |
| C、c(Na+)>c(CH3COO-) |
| D、c(Na+)=c(CH3COO-) |
下列关于材料的说法不正确的是( )
| A、太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 |
| B、二氧化硅可用作光导纤维 |
| C、石英玻璃耐强酸强碱,可用来制造化学仪器 |
| D、Si3N4是一种新型无机非金属材料,可用于制造发动机 |
四种基本类型反应与氧化反应的关系可用下列哪个图所示( )
A、 |
B、 |
C、 |
D、 |
碘是一种与人的生命活动密切相关的元素,已知I2能溶于NaOH或KI溶液,反应方程式分别为:3I2+6OH-═5I-+IO
+3H2O(HIO不稳定,易发生歧化反应)和I2+I-═I
,溴化碘(IBr)是一种卤素互化物,具有与卤素单质相似的性质,下列反应方程式中不正确的是( )
- 3 |
- 3 |
| A、IBr加入Na2S溶液中产生黄色浑浊:IBr+S2-═I-+Br-+S↓ | ||
B、IBr加入KI溶液中:IBr+2I-═Br-+I
| ||
| C、IBr加入NaOH溶液中:IBr+2OH-═BrO-+I-+H2O | ||
D、IBr加入AgNO3溶液中:3IBr+5Ag++3H2O═3AgBr↓+2AgI↓+IO
|
下列离子方程式正确的是( )
A、等物质的量浓度的FeBr2和CuCl2混合溶液用惰性电极电解最初发生反应:Cu2++2Br-
| ||||
| B、碳酸氢镁溶液中加入足量的烧碱溶液:Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O | ||||
| C、过量SO2通入氨水中:SO2+2NH3?H2O═2NH4++SO32-+H2O | ||||
| D、碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O |
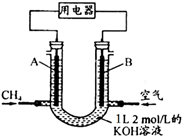 将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.
将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.