题目内容
9.常温下,将11.2g由CO2、CH4O、CO三种气体组成的混合气体直接通入到足量的Na2O2固体中,充分反应后,使Na2O2固体增重5.6g;若将同样的一组气体经过足量氧气充分燃烧后,再将燃烧后的气体混合物通入到足量的Na2O2固体中,充分反应后,使Na2O2固体增重为( )| A. | 6.2 g | B. | 8.8 g | C. | 8.0 g | D. | 11.2 g |
分析 使Na2O2固体增重5.6 g,发生反应2Na2O2+2CO2═2Na2CO3+O2;含碳元素的物质完全燃烧后再通入足量Na2O2固体,实际增加的为与CO2等物质的量的CO的质量;含氢的物质完全燃烧后再通入足量Na2O2固体,实际增加的为H原子的质量,以此来解答.
解答 解:混合气体直接通入到足量的Na2O2固体中,充分反应后,使Na2O2固体增重5.6 g,发生反应2Na2O2+2CO2═2Na2CO3+O2,
2Na2O2+2CO2═2Na2CO3+O2 △m
88 32 56
x 5.6g
可知参加反应的CO2的质量为$\frac{5.6g}{56}×88$=8.8 g,所以CH4O、CO的质量之和为11.2-8.8=2.4 g;
第二次经过燃烧后使Na2O2固体增重的反应过程中,根据反应方程式得到规律:含碳元素的物质完全燃烧后再通入足量Na2O2固体,实际增加的为与CO2等物质的量的CO的质量;含氢的物质完全燃烧后再通入足量Na2O2固体,实际增加的为H原子的质量,
则CH4O、CO的质量之和就是使Na2O2固体增加的质量,再加上CO2使Na2O2固体增重的5.6 g,即2.4g+5.6g=8.0 g,
故选C.
点评 本题考查化学反应方程式的计算,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与计算能力的考查,注意固体增重的判断,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
14.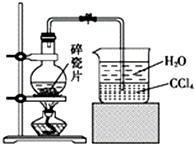 1-溴异戊烷[(CH3)2CHCH2CH2Br]是有机合成的重要中间体,可用于生产染料、催化剂等,其沸点为121℃,易溶于CCl4,可由异戊醇与氢溴酸在硫酸催化作用下反应而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知异戊醇的沸点为132.5℃,微溶于水,易溶于CCl4.实验室制备1-溴异戊烷的装置如图所示.
1-溴异戊烷[(CH3)2CHCH2CH2Br]是有机合成的重要中间体,可用于生产染料、催化剂等,其沸点为121℃,易溶于CCl4,可由异戊醇与氢溴酸在硫酸催化作用下反应而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知异戊醇的沸点为132.5℃,微溶于水,易溶于CCl4.实验室制备1-溴异戊烷的装置如图所示.
请回答下列问题:
(1)上述实验装置中长导管的作用是冷凝回流;导管末端插入CCl4中而不直接插入水中,除了能将挥发出的Br2、1-溴异戊烷等充分吸收外,另一个重要作用是防止倒吸.
(2)将1-溴异戊烷的粗产品置于分液漏斗中加水,振荡后静置,有机物将在下层(填“在上层”、“在下层”或“不分层”).
(3)在制备过程中,Br-可被氧化为Br2而引入杂质.欲除去Br2,可选用CE(填字母).
A.NaCl B.NaOH C.NaHSO3 D.KCl E.NaHCO3
(4)在制备1-溴异戊烷时,不能边反应边蒸出产物,其原因是1-溴丁烷与正丁醇的沸点差较小,若边反应边蒸出产物,会有较多的正丁醇挥发,降低原料的利用率.
(5)在实验室中还可用NaBr、浓H2SO4和异戊醇为原料制备1-溴异戊烷.已知反应物的用量如表:
若实验时1-溴异戊烷的产率为40%,则可制取1-溴异戊烷15.1g.
 1-溴异戊烷[(CH3)2CHCH2CH2Br]是有机合成的重要中间体,可用于生产染料、催化剂等,其沸点为121℃,易溶于CCl4,可由异戊醇与氢溴酸在硫酸催化作用下反应而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知异戊醇的沸点为132.5℃,微溶于水,易溶于CCl4.实验室制备1-溴异戊烷的装置如图所示.
1-溴异戊烷[(CH3)2CHCH2CH2Br]是有机合成的重要中间体,可用于生产染料、催化剂等,其沸点为121℃,易溶于CCl4,可由异戊醇与氢溴酸在硫酸催化作用下反应而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知异戊醇的沸点为132.5℃,微溶于水,易溶于CCl4.实验室制备1-溴异戊烷的装置如图所示.请回答下列问题:
(1)上述实验装置中长导管的作用是冷凝回流;导管末端插入CCl4中而不直接插入水中,除了能将挥发出的Br2、1-溴异戊烷等充分吸收外,另一个重要作用是防止倒吸.
(2)将1-溴异戊烷的粗产品置于分液漏斗中加水,振荡后静置,有机物将在下层(填“在上层”、“在下层”或“不分层”).
(3)在制备过程中,Br-可被氧化为Br2而引入杂质.欲除去Br2,可选用CE(填字母).
A.NaCl B.NaOH C.NaHSO3 D.KCl E.NaHCO3
(4)在制备1-溴异戊烷时,不能边反应边蒸出产物,其原因是1-溴丁烷与正丁醇的沸点差较小,若边反应边蒸出产物,会有较多的正丁醇挥发,降低原料的利用率.
(5)在实验室中还可用NaBr、浓H2SO4和异戊醇为原料制备1-溴异戊烷.已知反应物的用量如表:
| 反应物 | NaBr | 98.3% 浓H2SO4 | 异戊醇 | 水 |
| 用量 | 0.30mol | 35mL(过量) | 0.25mol | 30mL |
1.实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如表:
操作如下:
①在50mL三颈烧瓶中,加入18.5mL正丁醇和13.4mL冰醋酸,3~4滴浓硫酸,投入沸石.安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管.
②将分水器分出的酯层和反应液一起倒入分液漏斗中,水洗,10% Na2CO3洗涤,再水洗,最后转移至锥形瓶,干燥.
③将干燥后的乙酸正丁酯滤入烧瓶中,常压蒸馏,收集馏分,得15.1g乙酸正丁酯.
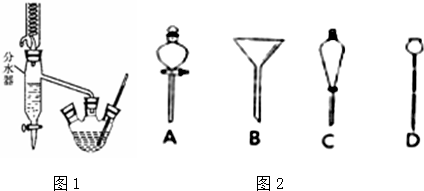
请回答有关问题:
(1)冷水应该从冷凝管a(填a或b)端管口通入.
(2)仪器A中发生反应的化学方程式为CH3COOH+CH3CH2CH2CH2OH CH3COOCH2CH2CH2CH3+H2O.
CH3COOCH2CH2CH2CH3+H2O.
(3)步骤①“不断分离除去反应生成的水”该操作的目的是:使用分水器分离出水,使平衡正向移动,提高反应产率.
(4)步骤②中用10%Na2CO3溶液洗涤有机层,该步操作的目的是除去产品中含有的乙酸等杂质.
(5)进行分液操作时,使用的漏斗是C(填选项).
(6)步骤③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏高(填“高”或者“低”)原因是会收集到少量未反应的冰醋酸和正丁醇
(7)该实验过程中,生成乙酸正丁酯的产率是65%.
| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点,/℃ | 溶解度/l00g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
①在50mL三颈烧瓶中,加入18.5mL正丁醇和13.4mL冰醋酸,3~4滴浓硫酸,投入沸石.安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管.
②将分水器分出的酯层和反应液一起倒入分液漏斗中,水洗,10% Na2CO3洗涤,再水洗,最后转移至锥形瓶,干燥.
③将干燥后的乙酸正丁酯滤入烧瓶中,常压蒸馏,收集馏分,得15.1g乙酸正丁酯.

请回答有关问题:
(1)冷水应该从冷凝管a(填a或b)端管口通入.
(2)仪器A中发生反应的化学方程式为CH3COOH+CH3CH2CH2CH2OH
 CH3COOCH2CH2CH2CH3+H2O.
CH3COOCH2CH2CH2CH3+H2O.(3)步骤①“不断分离除去反应生成的水”该操作的目的是:使用分水器分离出水,使平衡正向移动,提高反应产率.
(4)步骤②中用10%Na2CO3溶液洗涤有机层,该步操作的目的是除去产品中含有的乙酸等杂质.
(5)进行分液操作时,使用的漏斗是C(填选项).
(6)步骤③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏高(填“高”或者“低”)原因是会收集到少量未反应的冰醋酸和正丁醇
(7)该实验过程中,生成乙酸正丁酯的产率是65%.
18.下列各组物质或物质间反应可能包括多步反应,其总的离子方程式正确的是( )
| A. | 向NaClO溶液中通入过量SO2:ClO-+SO2+H2O═HClO+HSO3- | |
| B. | Na2S投入水中:S2-+2H2O?H2S+2OH- | |
| C. | 向含1molAlCl3溶液中投入4molNa:Al3++4Na+2H2O═AlO2-+4Na++2H2↑ | |
| D. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═Al(OH)3↓+3BaSO4↓ |
19.有机物X、Y的分子式不同,它们都只含C、H、O元素中的两种或三种,等物质的量的X和Y完全燃烧时消耗氧气和生成的二氧化碳的物质的量均相同,X、Y可能是( )
| A. | C2H4、C2H6O | B. | C2H2、C6H6 | C. | CH2O、C3H6O2 | D. | CH4、C2H4O2 |

 铜及其化合物在科学研究和工业生产中具有许多用途.
铜及其化合物在科学研究和工业生产中具有许多用途. ;
;