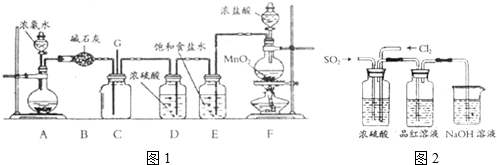
题目内容
6.化学与人类杜会生产、生活密切相关,下列说法正确的是( )| A. | DNOP(邻苯二甲酸二辛脂)是一种由邻苯二甲酸和正辛醇经脂化反应而得的一种酯类有机化合物,常用作增塑剂、溶剂以及气相色谱固定液,对人体无害,可用作食品添加剂 | |
| B. | 铝及其合金是电气、工业、家底广泛使用的材料,是因为铝的冶炼方法比较简单 | |
| C. | 陶瓷、砖瓦、玻璃、水泥都是硅酸盐产品 | |
| D. | 白酒标签上注有“酒精度52%Vol”字样,它表示100g该白酒中含有52g洒精 |
分析 A.邻苯二甲酸酯不可用作食品添加剂;
B.铝及其合金,具有很多优点:密度低,强度高,接近或超过优质钢,塑性好,可加工成各种型材,具有优良的导电性、导热性和抗蚀性,是电气、工业、家庭广泛使用的材料;
C.以含硅物质为原料经加热制成的,这一制造工业叫做硅酸盐工业,产品为硅酸盐产品,如制造水泥、玻璃、陶瓷、砖瓦等;
D.酒精度52%Vol为体积浓度.
解答 解:A.禁止在食品中添加指定种类邻苯二甲酸酯,不能用作食品添加剂,故A错误;
B.铝及其合金是电气、工业、家庭广泛使用的材料,是因为其良好的性质,故B错误;
C.陶瓷、砖瓦、玻璃、水泥主要成分都是硅酸盐,所以都是硅酸盐产品,故C正确;
D.白酒标签上注有“酒精度52%Vol”字样,它表示100L该白酒中含有52L酒精,故D错误;
故选:C.
点评 本题考查了生产、生活中常用到的化学知识,涉及食品添加剂、材料的应用、金属的冶炼、溶液浓度,题目难度不大,注意知识积累.

练习册系列答案
相关题目
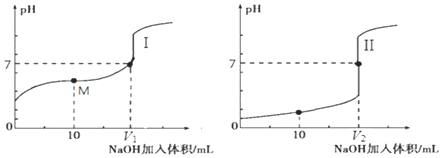
6.探究浓度对化学平衡的影响,实验如下:
Ⅰ.向5mL 0.05mol/L FeCl3溶液中加入5mL 0.05mol/L KI溶液(反应a),平衡后分为两等份
Ⅱ.向一份加入饱和KSCN溶液,变红(反应b);加入CCl4,振荡、静置,下层显极浅的紫色
Ⅲ.向另一份加入CCl4,振荡、静置,下层显紫红色
结合实验,下列说法不正确的是( )
Ⅰ.向5mL 0.05mol/L FeCl3溶液中加入5mL 0.05mol/L KI溶液(反应a),平衡后分为两等份
Ⅱ.向一份加入饱和KSCN溶液,变红(反应b);加入CCl4,振荡、静置,下层显极浅的紫色
Ⅲ.向另一份加入CCl4,振荡、静置,下层显紫红色
结合实验,下列说法不正确的是( )
| A. | 反应a为:2Fe3++2I-?2Fe2++I2 | B. | Ⅱ中,反应a进行的程度大于反应b | ||
| C. | 比较氧化性:Ⅱ中,I2>Fe3+ | D. | 比较水溶液中c(Fe2+):Ⅱ<Ⅲ |
17.设Na为阿伏加德罗常数的值.下列说法不正确的是( )
| A. | 常温下,100 g 46%乙醇水溶液中含有H原子数为12Na | |
| B. | 23g Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为Na | |
| C. | 标准状况下,2.24 L CC14含有的共价鍵数为0.4Na | |
| D. | l molN2与4molH2反应生成的NH3分子数小于2Na |
11.化学与生活、社会密切相关,下列说法不正确的是( )
| A. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| B. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于物理变化 | |
| C. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,分别可防止食物受潮、氧化变质 | |
| D. | 采用“静电除尘”“燃煤固硫”、“汽车尾气催化净化”可提高空气质量 |
18.下列有关元素周期表的说法中正确的是( )
| A. | 能生成碱的金属元素都在ⅠA族 | |
| B. | 稀有气体元素原子的最外层电子数为2或8 | |
| C. | 原子序数为14的元素位于元素周期表的第3周ⅥA族 | |
| D. | 元素周期表有18个纵行,分列16个族,即7个主族、8个副族和1个0族 |
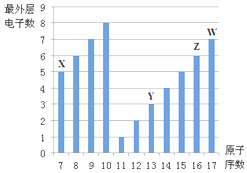 如图是部分短周期元素最外层电子数与原子序数的关系图.
如图是部分短周期元素最外层电子数与原子序数的关系图.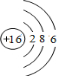 .
. .
.