题目内容
12.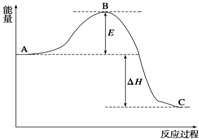 2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图
2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.
请回答下列问题:
(1)E的大小对该反应的反应热无影响?(填“有或无”).
该反应通常用V2O5作催化剂,加V2O5会使图中B点降低
(填“升高或降低”);
(2)图中△H=-198kJ/mol;
(3)如果反应速率υ(SO2)为0.05mol/(L•min),则υ(O2)=0.025mol/(L•min);
(4)1mol SO2(g)氧化为1mol SO3(g)的反应热△H1<1mol SO3(g)还原为1mol SO2(g)的反应热△H2.(填“>、<或=”)
(5)已知单质硫的燃烧热为296kJ/mol,计算由S(s)生成3mol SO3(l)的△H=-1185kJ/mol.
分析 (1)活化能的大小与反应热无关;使用催化剂降低活化能;
(2)根据参加反应SO2的物质的量之比等于对应的△H之比;
(3)速率之比等于对应物质的化学计量数之比,所以υ(O2)=$\frac{1}{2}$υ(SO2);
(4)1mol SO2(g)氧化为1mol SO3(g)是放热反应,而1mol SO3(g)还原为1mol SO2(g)是吸热反应;
(5)(2)单质硫的燃烧热为296KJ•mol-1,所以热化学方程式为:S(s)+O2(g)═SO2(g)△H=-296kJ/mol,利用盖斯定理解答该题.
解答 解:(1)反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关,E的大小对该反应的反应热无影响;加V2O5催化剂会使图中B点降低,
故答案为:无;降低;
(2)因1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ•mol-1,则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ•mol-1,故答案为:-198;
(3)速率之比等于对应物质的化学计量数之比,所以υ(O2)=$\frac{1}{2}$υ(SO2)=0.025mol/(L•min),故答案为:0.025;
(4)1mol SO2(g)氧化为1mol SO3(g)是放热反应,而1mol SO3(g)还原为1mol SO2(g)是吸热反应,所以△H1<△H2,故答案为:<;
(5)因单质硫的燃烧热为296kJ•mol-1,则S(s)+O2(g)=SO2(g)△H=-296kJ•mol-1,
而 1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,则SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H=-99kJ•mol-1,
由盖斯定律可得:S(s)+$\frac{3}{2}$O2(g)=SO3(g)△H=-296kJ•mol-1+(-99kJ•mol-1)=-395kJ•mol-1,
故答案为:S(s)+$\frac{3}{2}$O2(g)═SO3(g)△H=-395kJ•mol-1,所以S(s)生成3mol SO3(l)的反应热为:3×395kJ•mol-1=-1185 kJ/mol,故答案为:-1185 kJ/mol.
点评 本题综合考查反应热与焓变,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意催化剂对反应的影响以及反应热计算的应用,题目较简单.

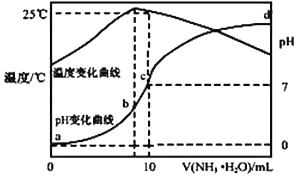 在某温度时,将 n mol•L-1氨水滴入 10mL 1.0mol•L-1 盐酸中,溶液 pH 和温度随加入氨 水体积变化曲线如图所示,下列有关说法正确的是( )
在某温度时,将 n mol•L-1氨水滴入 10mL 1.0mol•L-1 盐酸中,溶液 pH 和温度随加入氨 水体积变化曲线如图所示,下列有关说法正确的是( )| A. | a 点 Kw=1.0×10-14 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | b 点:c(NH4+)>c(Cl-)>c(H +)>c(OH -) | |
| D. | 25℃时 NH4Cl 水解常数为(10n-1)×10-7mol•L-1(用 n 表示) |
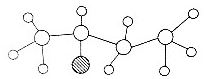
| A. | 该有机物肯定是的含烃氧衍生物 | |
| B. | 该有机物能发生取代反应和加成反应 | |
| C. | 该有机物可能是C4H9Cl | |
| D. | 该有机物可能与CH3CH2OCH2CH2互为同分异构体 |
 合成氨工业是我省开磷集团的重要支柱产业之一.氨是一种重要的化工原料,在工农业生产中有广泛的应用.
合成氨工业是我省开磷集团的重要支柱产业之一.氨是一种重要的化工原料,在工农业生产中有广泛的应用.(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2?2NH3.该可逆反应达到平衡的标志是C;
A.3v(H2)正=2v(NH3)逆
B.单位时间生成mmolN2的同时生成3mmolH2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
(2)氨气具有还原性,例如,氨气能与卤素单质发生置换反应.已知几种化学键的键能数据如表所示:
请写出氨气与溴蒸汽反应的热化学方程式2NH3 (g)+3Br2(g)=N2(g)+6HBr(g)△H=-214KJ/mol;
| 化学键 | N-H | N≡N | Br-Br | H-Br |
| 键能/kJ•mol-1 | 391 | 946 | 194 | 366 |
| 时间/min | CH4(mol) | H2O(mol) | CO (mol) | H2 (mol) |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | a | 0.80 | c | 0.60 |
| 7 | 0.20 | b | 0.20 | d |
| 10 | 0.21 | 0.81 | 0.19 | 0.64 |
②该温度下,上述反应的平衡常数K=0.0675;
③反应在7-10min内,CO的物质的量减少的原因可能是D(填字母)
A.减少CH4的物质的量 B.降低温度 C.升高温度 D.充入H2
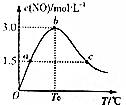
(4)氨的催化氧化:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)是工业制硝酸的重要反应.在1L密闭容器中充入4molNH3(g)和5molO2(g),保持其他条件不变,测得c(NO)与温度的关系如图所示.该反应的△H<0(填“>”、“<”
或“=”);T0温度下,NH3的转化率为75%.
| A. | 常温下,100 g 46%乙醇水溶液中含有H原子数为12Na | |
| B. | 23g Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为Na | |
| C. | 标准状况下,2.24 L CC14含有的共价鍵数为0.4Na | |
| D. | l molN2与4molH2反应生成的NH3分子数小于2Na |
(1)在一定条件下:2N2(g)+6H2O(g)=4NH3(g)+3O2(g).已知该反应的相关的化学键键能数据如表一:
表一:
| 化学键 | N≡N | H-O | N-H | O=O |
| E/(kJ/mol) | 946 | 463 | 391 | 496 |
(2)在恒容密闭容器中充入2molNO2与1molO2发生反应如下:4NO2(g)+O2(g)?2N2O5(g)
①已知在不同温度下测得N2O5的物质的量随时间的变化如图1所示.常温下,该反应能逆向自发进行,原因是逆反应方向的△S>0.
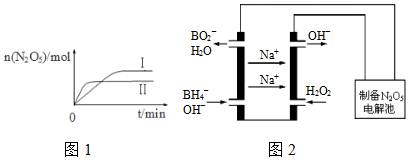
②下列有关该反应的说法正确的是BD.
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
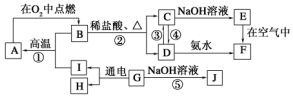
(3)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图2.则硼氢化钠燃料电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O.
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种.上表二是常温下浓度均为0.01mol/L的X、Y、Z、W溶液的pH.将X、Y、Z各1mol同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+).
表二:
| .01mol/L 的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
Ⅰ:2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g) K1
Ⅱ:2NO(g)+Cl2(g)?2ClNO(g) K2
①4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$(用K1、K2表示)
②在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min时反应Ⅱ达到平衡.测得10min内v(ClNO)=7.5×10-3mol/(L•min),则平衡时NO的转化率α1=75%;其他条件不变,反应Ⅱ在恒压条件下进行,平衡时NO的转化率α2>α1(填“>”“<”或“=”)
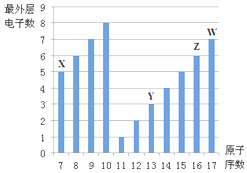 如图是部分短周期元素最外层电子数与原子序数的关系图.
如图是部分短周期元素最外层电子数与原子序数的关系图.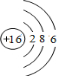 .
. .
.