题目内容
12.如图甲为实验室某浓度盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:(1)该浓盐酸中HCl的物质的量浓度为11.9mol•L-1.
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是BD.
A.溶液中HCl的物质的量 B.溶液的浓度 C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400mol•L-1的稀盐酸.
①该学生需要量取16.8mL上述浓盐酸进行配制.
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填“偏大”“偏小”或“无影响”).
a.用量筒量取浓盐酸时俯视观察凹液面:偏小.
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水:偏小.
(4)硅单质是一种重要的非金属单质,其用途是半导体 电子芯片 光电池(举一例)
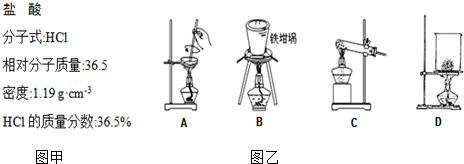
(5)SiO2和NaOH焙烧制备硅酸钠,可采用如图乙的装置为B(填代号).
(6)某H2中含有2.40molCO2,该混合气体通入2.00L NaOH溶液中,CO2被完全吸收.如果NaOH完全反应,该NaOH溶液的浓度为2.4 mol/L≥c≥1.2 mol/L.
分析 (1)依据C=$\frac{1000ρω}{M}$计算浓盐酸的物质的量浓度;
(2)盐酸溶液中,溶液浓度、溶液密度都与溶液体积大小无关,而氯化氢的物质的量、氯离子数目与溶液体积大小有关;
(3)①.依据溶液稀释过程中溶质的物质的量保持不变计算解答;
②.分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(4)依据硅导电性介于导体与绝缘体之间,是一种良好的半导体材料解答;
(5)A、蒸发皿中含有二氧化硅和氢氧化钠反应;
B、铁坩埚可以熔融二氧化硅和氢氧化钠;
C、玻璃中含二氧化硅和氢氧化钠反应;
D、烧杯中含有二氧化硅和氢氧化钠反应;
(6)2.40molCO2与NaOH完全反应,产物可能为Na2CO3或NaHCO3或二者都有,结合质量守恒解答.
解答 解:(1)该浓盐酸中HCl的物质的量浓度C=$\frac{1000×1.19×36.5%}{36.5}$=11.9mol/L,故答案为:11.9;
(2)A.溶液中HCl的物质的量大小取决于溶液体积大小和溶液浓度,故A错误;
B.溶液具有均一性,溶液的浓度与溶液体积大小无关,故B正确;
C.溶液中Cl-的数目与溶液浓度、溶液体积大小及溶质化学式组成有关,故C错误;
D.溶液具有均一性,溶液的密度与溶液体积大小无关,故D正确;
故答案为:BD;
(3)①设需要浓盐酸体积为V,则依据溶液稀释过程中溶质的物质的量保持不变得V×11.9mol/L=0.400mol•L-1×500mL,解得V=16.8mL;
故答案为:16.8;
②a.用量筒量取浓盐酸时俯视观察凹液面,导致量取的浓盐酸体积偏小,溶质氯化氢的物质的量偏小,溶液浓度偏小;
故答案为:偏小;
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水,导致溶液体积偏大,溶液浓度偏小;
故答案为:偏小;
(4)硅是一种良好的半导体材料,可以用于做半导体 电子芯片 光电池;
故答案为:半导体 电子芯片 光电池;
(5)A、蒸发皿中含有二氧化硅和氢氧化钠反应;
B、铁坩埚可以熔融二氧化硅和氢氧化钠;
C、玻璃中含二氧化硅和氢氧化钠反应;
D、烧杯中含有二氧化硅和氢氧化钠反应;
故选:B;
(6)2.40molCO2与NaOH完全反应,产物可能为Na2CO3或NaHCO3或二者都有,
假设全部生成生成NaHCO3,则发生CO2+NaOH=NaHCO3,n(NaOH)=n(CO2)=2.40mol,则c(NaOH)=$\frac{2.4mol}{2.00L}$=1.20mol/L;
假设全部生成,则发生CO2+2NaOH=Na2CO3,n(NaOH)=2n(CO2)=4.80mol,则c(NaOH)=$\frac{4.80mol}{2.00L}$=2.40mol/L;
综合以上两种情况可知,NaOH溶液的浓度应该1.20mol/L≤c(NaOH)≤2.40mol/L.
故答案为:2.4 mol/L≥c≥1.2 mol/L.
点评 本题为综合题,考查了一定物质的量浓度溶液的配制,硅及其化合物性质与用途,有关方程式计算,综合考查学生的分析、计算能力,题目难度中等,注意计算时端值法和守恒法的应用.

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案| A. | 煤的主要成分是单质碳 | |
| B. | 煤的干馏是指将煤在空气中加强热使之分解的过程 | |
| C. | 煤通过干馏得到的苯和甲苯属于同系物 | |
| D. | 煤气化的目的主要是获得甲烷,煤液化的目的主要是获得苯 |
| A. | 乙醇、丙三醇互为同系物,同系物之间不可能互为同分异构体 | |
| B. | 液化石油气和天然气的主要成分都是甲烷 | |
| C. | 间二溴苯仅有一种空间结构的事实可证明苯分子中不存在单双键交替的结构 | |
| D. | (CH3)2C=CHCH2CH3分子中的6个碳原子中至少有5个在同一个平面上 |
| A. | Cu、Fe3+、Fe | B. | Fe2+、Fe3+、Fe | C. | Cu、Cu2+、Fe | D. | Cu、Fe2+、Fe |
 用图所示装置制取表格中的四种干燥、纯净的气体(必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).其中正确的是( )
用图所示装置制取表格中的四种干燥、纯净的气体(必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).其中正确的是( )| 选项 | 气体 | a | b | c | d |
| A | SO2 | 浓硫酸 | Cu | H2O | 浓硫酸 |
| B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
| C | NH3 | 饱和NH4Cl溶液 | 消石灰 | 空集气瓶 | 固体NaOH |
| D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 葡萄糖、油脂、蛋白质都是由C、H、O三种元素组成的 | |
| B. | 油脂有油和脂肪之分,都属于酯 | |
| C. | 葡萄糖、果糖和蔗糖都能发生水解反应 | |
| D. | 糖类、油脂、蛋白质都是高分子化合物 |
| A. | 若样品为水溶液且只取一次有机物,检验 中官能团,应该先向其中加入 三氯化铁溶液检验酚羟基;再加入足量氢氧化钠溶液,加热,用稀硝酸酸化后,最后加入 硝酸银溶液检验氯原子 中官能团,应该先向其中加入 三氯化铁溶液检验酚羟基;再加入足量氢氧化钠溶液,加热,用稀硝酸酸化后,最后加入 硝酸银溶液检验氯原子 | |
| B. | 只检验 CH2=CH-CHO 中的碳碳双键不能用溴水,但是可以用溴的四氯化碳溶液 | |
| C. | 若样品为水溶液且只取一次有机物,检验 ClCH2COOH 中官能团,应该先加入足量氢 氧化钠溶液,加热,再用足量稀硝酸酸化后,加入硝酸银溶液检验氯原子;最后加入碳酸 氢钠溶液检验羧基 | |
| D. | 若样品为水溶液且只取一次有机物,检验邻羟基苯甲醇中的官能团,应该先加入紫色 石蕊试液检验酚羟基;再加入金属钠检验醇羟基 |
| A. | 等于7 | B. | 小于7 | C. | 大于7 | D. | 不能确定 |
