题目内容
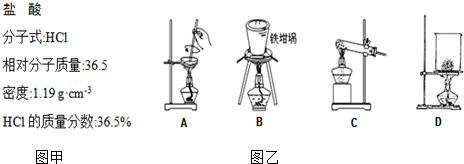
17. 用图所示装置制取表格中的四种干燥、纯净的气体(必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).其中正确的是( )
用图所示装置制取表格中的四种干燥、纯净的气体(必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).其中正确的是( )| 选项 | 气体 | a | b | c | d |
| A | SO2 | 浓硫酸 | Cu | H2O | 浓硫酸 |
| B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
| C | NH3 | 饱和NH4Cl溶液 | 消石灰 | 空集气瓶 | 固体NaOH |
| D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.依据二氧化硫能够溶于水分析解答;
B.氯气能够与氢氧化钠溶液反应;
C.氨气密度比空气小;
D.铜和稀硝酸反应生成一氧化氮,一氧化氮和水不反应,所以可以用水作洗液吸收被氧气氧化的二氧化氮及挥发的硝酸.
解答 解:A.二氧化硫能够溶于水,反应生成的气体通过盛有水的C装置,二氧化硫溶于水,得不到气体,故A错误;
B.氯气能够与氢氧化钠溶液反应,制取的氯气通过盛有氢氧化钠溶液,氯气被吸收,得不到氯气,故B错误;
C.氨气密度比空气小,应用向下排空发生收集,故C错误;
D.铜和稀硝酸反应生成一氧化氮,一氧化氮和水不反应,所以可以用水作洗液吸收被氧气氧化的二氧化氮及挥发的硝酸,可用浓硫酸干燥,故D正确;
故选D.
点评 本题考查了气体的反应、洗气和干燥装置,为高频考点,侧重于学生的分析、实验能力的考查,明确气体制备原理和性质是解题关键,注意把握实验的合理性和可行性的评价,题目难度不大.

练习册系列答案
相关题目
7.下列说法中用离子方程式表达正确的是( )
| A. | 氯气溶于水:Cl2+H2O?H++Cl-+HClO | |
| B. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2A1 (OH)3↓+CO32- | |
| C. | Fe(NO3)2溶液中滴加少量稀盐酸:Fe2++NO3-+4H+=Fe3++NO↑+2H2O | |
| D. | 用醋酸溶液除去水垢:2H++CaCO3=Ca2++CO2↑+H2O |
8.下列化工生产原理错误的是( )
①可以用电解熔融的氯化钠的方法来制取金属钠.
②可以用钠加入氯化镁饱和溶液中制取镁.
③用电解法制铝时,原料是氯化铝.
④炼铁高炉中所发生的反应都是放热的,故无需加热.
①可以用电解熔融的氯化钠的方法来制取金属钠.
②可以用钠加入氯化镁饱和溶液中制取镁.
③用电解法制铝时,原料是氯化铝.
④炼铁高炉中所发生的反应都是放热的,故无需加热.
| A. | ② | B. | ②③ | C. | ①②③ | D. | ②③④ |
5.实验室用锌片与2mol/L硫酸溶液制取氢气,下列措施不能使反应速率加快的是( )
| A. | 加热 | |
| B. | 滴加少量的CuSO4溶液 | |
| C. | 不用稀硫酸,改用更多的18mol/L硫酸溶液 | |
| D. | 不用铁片,改用铁粉 |
2.用一种试剂可将四氯化碳、苯、甲苯鉴别出来,该试剂是( )
| A. | 稀硫酸 | B. | 水 | C. | 溴水 | D. | 酸性高锰酸钾 |
6.由金红石TiO2制取单质Ti,涉及到的步骤为:
已知:①C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ/mol
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);△H3=+141kJ/mol
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H 为( )
已知:①C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ/mol
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);△H3=+141kJ/mol
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H 为( )
| A. | -80 kJ/mol | B. | -90 kJ/mol | C. | -60 kJ/mol | D. | -70 kJ/mol |
 二氧化硫和氮的氧化物是大气的主要污染物,防止和治理其对环境的污染是当前环保工作的重要研究内容之一.
二氧化硫和氮的氧化物是大气的主要污染物,防止和治理其对环境的污染是当前环保工作的重要研究内容之一.