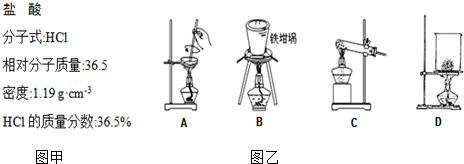
题目内容
7.将Fe、Cu加入含Fe2+、Fe3+和Cu2+的溶液中充分反应,如Fe有剩余,则反应器中金属元素的存在形式只能是( )| A. | Cu、Fe3+、Fe | B. | Fe2+、Fe3+、Fe | C. | Cu、Cu2+、Fe | D. | Cu、Fe2+、Fe |
分析 金属的还原性为:Fe>Cu,相同条件下,铁优于铜先参加反应;离子的氧化性为:Fe3+>Cu2+>Fe2+,相同条件下,铁离子先被还原,其次是铜离子;根据Fe有剩余,金属铜不会参加反应,铁离子、铜离子不会存在进行判断.
解答 解:由于铁粉有剩余,金属的还原性为:Fe>Cu,所以金属铜不会参加反应,容器中一定存在铜;能够与铁粉反应有铁离子和铜离子,所以铜离子和铁离子不会存在,与铁粉反应后生成了金属铜和亚铁离子,所以容器中一定存在亚铁离子,即反应后容器中一定存在:Cu、Fe、Fe2+,
故选D.
点评 本题考查了离子反应发生条件及离子氧化性、还原性强弱比较,题目难度不大,完成此题,可以依据金属活动性顺序及其意义来完成.

练习册系列答案
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案
相关题目
17.下列说法不正确的是( )
| A. | 使用溴水或酸性KMnO4溶液都可鉴别乙烯和甲烷 | |
| B. | 在加热或加入重金属盐的情况下,蛋白质都可发生变性 | |
| C. | 液化石油气和天然气的主要成分都是甲烷 | |
| D. | 淀粉水解的最终产物是葡萄糖 |
15.某厂平均每天产生约600m3废氨水(NH3 的浓度为153mg•L-1,密度为1g•cm-3).
(1)该废氨水中氨的物质的量浓度为9×10-3mol/L.
(2)对废氨水进行加热蒸发得到NH3,使废氨水中的NH3的浓度降为17mg•L-1.忽略蒸发前后废氨水体积变化,则上述体积的废氨水蒸发出来的NH3的物质的量为4800 mol.(以下计算结果均保留两位小数)
(3)蒸发得到的NH3可用于制备NO.4NH3+5O2→4NO+6H2O;(不考虑NO与氧气的反应),设空气中氧气的体积分数为0.20,氮气体积分数为0.80.
①为使NH3恰好完全氧化为NO,氨-空气混合物中氨的体积分数为0.14.
②氨催化氧化制取NO同时会发生副反应:4NH3+3O2→2N2+6H2O.将1L NH3混合10L空气后通入反应器,反应完成后,测得混合气体中不含NH3,而O2和N2的物质的量之比为1:10,试求参加主反应的氨占原料氨的体积百分含量.
(4)废氨水可用于脱除烟气中的SO2.氨水吸收烟气中SO2经氧化后生成(NH4)2SO4和NH4HSO4混合物.现称取不同质量的混合物进行实验,结果如下:
试计算生成氨气的质量最大时样品的质量.
(1)该废氨水中氨的物质的量浓度为9×10-3mol/L.
(2)对废氨水进行加热蒸发得到NH3,使废氨水中的NH3的浓度降为17mg•L-1.忽略蒸发前后废氨水体积变化,则上述体积的废氨水蒸发出来的NH3的物质的量为4800 mol.(以下计算结果均保留两位小数)
(3)蒸发得到的NH3可用于制备NO.4NH3+5O2→4NO+6H2O;(不考虑NO与氧气的反应),设空气中氧气的体积分数为0.20,氮气体积分数为0.80.
①为使NH3恰好完全氧化为NO,氨-空气混合物中氨的体积分数为0.14.
②氨催化氧化制取NO同时会发生副反应:4NH3+3O2→2N2+6H2O.将1L NH3混合10L空气后通入反应器,反应完成后,测得混合气体中不含NH3,而O2和N2的物质的量之比为1:10,试求参加主反应的氨占原料氨的体积百分含量.
(4)废氨水可用于脱除烟气中的SO2.氨水吸收烟气中SO2经氧化后生成(NH4)2SO4和NH4HSO4混合物.现称取不同质量的混合物进行实验,结果如下:
| NaOH 溶液体积/mL | 40.00 | 40.00 | 40.00 |
| 样品质量/g | 7.75 | 15.50 | 23.25 |
| 氨气质量/g | 1.87 | 1.87 | 1.7 |
19.下列说法正确的是( )
| A. | 以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,故溶液pH不变 | |
| B. | 电解稀氢氧化钠溶液要消耗OH-,故溶液pH减小 | |
| C. | 电解硫酸钠溶液,在阴极上发生反应:4OH--4e-═2H2O+O2↑ | |
| D. | 电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1 |
16.能发生消去反应,生成物中不存在同分异构体的是( )
| A. |  | B. |  | C. | HC≡C-CH2Cl | D. | (CH3CH2)3COH |
17.下列物质与溴水混合后振荡,静置.溶液分层且上层呈红棕色的是( )
| A. | 苯 | B. | 酒精 | C. | 四氯化碳 | D. | 碘化钾溶液 |
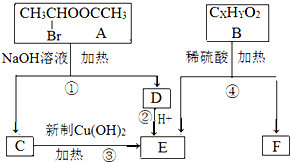 六种有机物之间的转化关系如图.已知:一个碳原子上连有两个羟基的结构极不稳定,易发生变化:R-CH(OH)2→RCHO+H2O
六种有机物之间的转化关系如图.已知:一个碳原子上连有两个羟基的结构极不稳定,易发生变化:R-CH(OH)2→RCHO+H2O
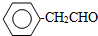 或
或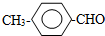 或(邻位、间位).
或(邻位、间位).