题目内容
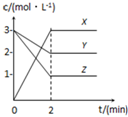 如图表示800℃时,X、Y、Z三种气体物质的浓度随时间变化的情况.试回答:
如图表示800℃时,X、Y、Z三种气体物质的浓度随时间变化的情况.试回答:(1)该反应的反应物为
(2)该反应的化学方程式为
(3)0~2min Y物质的化学反应速率为
(4)Z物质的平衡转化率为
(5)800℃时,该反应的平衡常数K=
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)反应物在反应中浓度降低;
(2)根据物质浓度的变化量确定化学方程式;
(3)0~2min Y物质的浓度变化,计算化学反应速率;
(4)利用Z转化的浓度与起始浓度的比值确定Z的转化率;
(5)计算出平衡时三种物质的浓度,利用化学平衡常数表达式计算化学平衡常数值.
(2)根据物质浓度的变化量确定化学方程式;
(3)0~2min Y物质的浓度变化,计算化学反应速率;
(4)利用Z转化的浓度与起始浓度的比值确定Z的转化率;
(5)计算出平衡时三种物质的浓度,利用化学平衡常数表达式计算化学平衡常数值.
解答:
解:(1)反应物在反应中浓度降低,根据图象中曲线可知Y、Z浓度降低,故答案为Y、Z;
(2)Y浓度减小了(3-2)mol/L=1mol/L,Z浓度减小了(3-1)mol/L=2mol/L,X浓度增大了3mol/L,故计量数之比为1:2:3,化学方程式为:Y+2Z?3X,故答案为:Y+2Z?3X;
(3)0~2min Y物质的浓度减小了1mol/L,其化学反应速率为
=0.5mol/(L?min),故答案为:0.5mol/(L?min);
(4)Z浓度减小了2mol/L,Z起始浓度为3mol/L,转化率为:
×100%=66.67%,故答案为:66.67%;
(5)平衡时,Y浓度为2mol/L,Z浓度为1mol/L,X浓度为3mol/L,K=
=
=13.5,故答案为:13.5.
(2)Y浓度减小了(3-2)mol/L=1mol/L,Z浓度减小了(3-1)mol/L=2mol/L,X浓度增大了3mol/L,故计量数之比为1:2:3,化学方程式为:Y+2Z?3X,故答案为:Y+2Z?3X;
(3)0~2min Y物质的浓度减小了1mol/L,其化学反应速率为
| 1mol/L |
| 2min |
(4)Z浓度减小了2mol/L,Z起始浓度为3mol/L,转化率为:
| 2mol/L |
| 3mol/L |
(5)平衡时,Y浓度为2mol/L,Z浓度为1mol/L,X浓度为3mol/L,K=
| c3(X) |
| c(Y)?c2(Z) |
| (3mol/L)3 |
| (2mol/L)×(1mol/L)2 |
点评:考查平衡图象、化学平衡有关计算、平衡常数的计算等,难度不大,注意基础知识的理解掌握.

练习册系列答案
相关题目
从柑桔中炼制萜二烯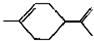 ,下列有关它的推测不正确的是( )
,下列有关它的推测不正确的是( )
 ,下列有关它的推测不正确的是( )
,下列有关它的推测不正确的是( )| A、分子式为C10H16 |
| B、常温下为液态,难溶于水 |
C、与过量的溴的CCl4溶液反应后产物为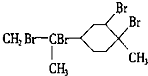 |
| D、它不能使酸性高锰酸钾溶液褪色 |
 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示,下列说法正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示,下列说法正确的是( )| A、反应开始到第一次平衡时,N2的平均反应速率为 0.005mol/(L?min) |
| B、从曲线变化可以看出,反应进行到10min至20min时可能是使用了催化剂 |
| C、从曲线变化可以看出,反应进行至25min时,分离出0.1mol的氨气 |
| D、在25min时平衡正向移动,但达到新平衡后NH3的体积分数比原平衡小 |